O uso de tecnologias como aparelhos de anestesia e ventiladores de transporte desempenha um papel decisivo na segurança e eficiência de hospitais e serviços de urgência e emergência.
A ventilação mecânica é um recurso vital em unidades de terapia intensiva, frequentemente utilizado em pacientes com insuficiência respiratória, traumas graves ou em estado crítico. No entanto, sua aplicação não está isenta de riscos.
Estudos apontam que o uso prolongado pode levar a complicações graves, como fraqueza muscular adquirida em UTI, úlceras de pressão, delirium e infecções como a sepse nosocomial e a pneumonia associada à ventilação mecânica (PAV) — esta última com taxas de incidência entre 9% e 27% e impacto significativo na mortalidade hospitalar¹.
Por outro lado, estratégias bem estruturadas, como a ventilação mecânica protetora (com volumes correntes reduzidos e controle rigoroso da pressão), têm mostrado benefícios claros na redução de lesões pulmonares induzidas por ventilação e na melhora dos desfechos clínicos². Além disso, medidas complementares, como protocolos de higiene bucal em pacientes ventilados, também demonstraram eficácia na prevenção de PAV, contribuindo para a segurança e recuperação mais rápida dos pacientes³.
Esse cenário reforça a importância de adotar não apenas tecnologias avançadas, como ventiladores de transporte e compressores torácicos, mas também protocolos clínicos baseados em evidência que otimizem o cuidado crítico e reduzam os riscos associados à ventilação mecânica.
Ventilação mecânica: um pilar da terapia intensiva moderna
A ventilação mecânica é um dos recursos mais críticos em ambientes de cuidado intensivo. Ela oferece suporte respiratório imediato a pacientes com insuficiência respiratória, sedação profunda, traumas ou patologias que comprometem a troca gasosa. Seu uso adequado não apenas melhora os desfechos clínicos, mas também reduz complicações, tempo de internação e mortalidade.
Para isso, os hospitais precisam contar com equipamentos versáteis, seguros e tecnicamente avançados, que funcionem tanto à beira-leito quanto em contextos de transporte interno ou emergências extra hospitalares.
Aparelhos de anestesia: papel estratégico na ventilação mecânica intraoperatória
Durante procedimentos cirúrgicos, o aparelho de anestesia desempenha um papel central na manutenção da ventilação mecânica segura e contínua.
Esses dispositivos são responsáveis por administrar gases anestésicos e oxigênio, além de controlar parâmetros ventilatórios com precisão — fundamentais para pacientes sob anestesia geral, que perdem a capacidade de respirar espontaneamente.
Em especial, em cirurgias prolongadas ou de alta complexidade, a escolha de um sistema de anestesia com ventilador integrado de alta performance impacta diretamente na redução de lesões pulmonares induzidas por ventilação, na estabilidade hemodinâmica e na segurança do paciente ao longo do procedimento.
Ventilador de transporte: mobilidade com estabilidade respiratória
O ventilador de transporte é essencial para manter a continuidade da assistência ventilatória durante deslocamentos intra-hospitalares, transferências inter-hospitalares ou atendimentos em ambulâncias e UTIs móveis. Sua atuação é estratégica em procedimentos como:
- Transferência de pacientes intubados entre setores (ex: UTI → centro cirúrgico);
- Atendimento em ambientes remotos ou durante o transporte aéreo;
- Resposta rápida em eventos adversos e desastres com múltiplas vítimas.
Modelos modernos contam com modos ventilatórios invasivos e não invasivos, bateria de longa duração e alarmes inteligentes, garantindo suporte estável e adaptável em diferentes contextos clínicos.
Além disso, seu uso reduz riscos como desconexão, hipóxia ou falhas na ventilação manual, reforçando a segurança do paciente em momentos críticos.
Compressor torácico: reanimação com eficiência padronizada
Durante paradas cardiorrespiratórias, a qualidade da compressão torácica é determinante para a sobrevida do paciente. O compressor torácico automatizado realiza compressões rítmicas, contínuas e com profundidade padronizada — superando limitações da reanimação manual, como fadiga do socorrista e variações na técnica. Muitas vezes, podendo ser utilizado em sincronia com ventiladores pulmonares.
Estudos indicam que esses dispositivos proporcionam compressões com pressão e frequência constantes, alinhadas às práticas baseadas em evidências mais recentes⁴. Além disso, são fáceis de usar e podem salvar vidas em situações críticas.
Além de melhorar os resultados clínicos dos pacientes, o uso desses dispositivos também reduz o risco de transmissão de doenças aos profissionais de saúde durante a RCP, especialmente em contextos de pandemias, como a COVID-19⁵. Sua adoção contribui para a padronização dos procedimentos, melhora a eficiência da equipe e aumenta as taxas de retorno à circulação espontânea (ROSC).
A adoção desses dispositivos contribui para:
- Maior eficácia na reanimação cardiopulmonar (RCP);
- Liberação da equipe médica para outros cuidados simultâneos;
- Redução de lesões associadas à RCP mal executada;
- Aumento das taxas de retorno à circulação espontânea (ROSC).
Sua aplicação é especialmente valiosa em setores como emergência, UTI, transporte avançado e centros cirúrgicos, onde cada segundo e cada compressão fazem a diferença.
Integração estratégica e impacto na segurança do paciente
Integrar tecnologias como aparelhos de anestesia, ventiladores de transporte e compressores torácicos ao protocolo melhora significativamente a resposta a situações críticas. Quando utilizadas em conjunto, essas ferramentas:
- Garantem continuidade ventilatória e hemodinâmica;
- Reduzem riscos humanos durante procedimentos de urgência;
- Aumentam a taxa de recuperação neurológica após paradas cardiorrespiratórias;
- Suportam condutas baseadas em evidência com maior precisão.
Além disso, contribuem para melhor gestão de recursos humanos, otimizando o tempo da equipe e padronizando procedimentos de alto risco.
Carestation 650 da GE Healthcare: precisão e segurança na ventilação mecânica
O Carestation™ 650 da GE Healthcare é uma estação de anestesia avançada que oferece suporte ventilatório de alta precisão para pacientes de todas as idades, desde neonatos até adultos.
Equipado com um sistema de ventilação de válvula de fluxo digital, o Carestation 650 permite a entrega de volumes correntes tão baixos quanto 5 mL, essencial para estratégias de ventilação protetora em pacientes pediátricos e neonatais.
Além disso, recursos como os procedimentos automatizados de Capacidade Vital e Ciclagem auxiliam na execução de manobras de recrutamento alveolar e ajustes de PEEP, promovendo uma ventilação mais segura e eficaz.
A funcionalidade “Pause Gas Flow” permite interromper temporariamente todos os fluxos de gás e alarmes, facilitando intervenções clínicas sem comprometer a segurança do paciente.
Com um design compacto e interface intuitiva, o Carestation 650 integra-se perfeitamente aos ambientes hospitalares, contribuindo para a redução de complicações associadas à ventilação mecânica e aprimorando os desfechos clínicos.
Ventiladores de Transporte da Amoul: Tecnologia que Redefine a Mobilidade
Já voltado para urgência e emergência, os ventiladores de transporte da Amoul representam o ápice da tecnologia em cuidados intensivos móveis.
Projetados para garantir precisão e segurança em ambientes dinâmicos, esses dispositivos oferecem uma resposta rápida e eficaz, essencial para situações de alta complexidade hospitalar. Com recursos avançados que incluem modos adaptáveis de ventilação e monitoramento contínuo, os ventiladores Amoul são fundamentais para elevar o padrão de cuidado intensivo onde quer que seja necessário.
Compressor Torácico E6: excelência em assistência cardíaca
Pensando em um suporte, o compressor torácico E6 é a escolha ideal para garantir uma resposta eficiente em eventos cardíacos críticos.
Projetado para proporcionar compressões torácicas consistentes e precisas, este dispositivo não apenas aumenta a segurança do paciente, mas também otimiza a operacionalidade da equipe médica. Com sua tecnologia avançada e facilidade de uso, o compressor E6 permite uma atuação rápida e eficaz, essencial para melhorar os resultados em situações de emergência médica.
Essas soluções da Amoul não apenas redefinem a mobilidade e a eficiência operacional em cuidados intensivos, mas também garantem que cada intervenção médica seja realizada com máxima precisão e segurança, independentemente do desafio apresentado pelo ambiente hospitalar.
Conclusão: tecnologia que salva vidas com precisão e mobilidade
Investir em dispositivos como aparelhos de anestesia, ventilador de transporte e compressor torácico é investir em excelência operacional, segurança do paciente e resposta rápida em ambientes de alta complexidade. Essas tecnologias elevam o padrão de cuidado intensivo e permitem que a equipe hospitalar atue com máxima eficácia mesmo nas situações mais desafiadoras.
Fale com a MA Hospitalar e fortaleça sua estratégia de cuidados críticos
Na MA Hospitalar oferecemos suporte técnico especializado e soluções em ventilação e emergência reconhecidas pela confiabilidade, durabilidade e desempenho clínico. Fale com nosso time e descubra como garantir monitoramento e suporte ventilatório inteligentes em todos os pontos da jornada hospitalar. Acesse nossa loja e conheça os produtos!
Referências:
- https://www.rmmg.org/artigo/detalhes/1865
- https://www.scielo.br/j/rba/a/XBpzqJgHMj3S49wS5T5DcDn
- https://pubmed.ncbi.nlm.nih.gov/29189950
- https://www.cochrane.org/pt/CD007260/VASC_maquinas-de-compressao-mecanica-do-torax-para-pessoas-em-parada-cardiaca
- https://rsdjournal.org/index.php/rsd/article/view/14241
O otoscópio é um instrumento médico usado para examinar o ouvido, permitindo a visualização do canal auditivo e do tímpano. Ele é importante para diagnosticar infecções, bloqueios ou outras condições auriculares.
O otoscópio é um instrumento muito usado por clínicos gerais e otorrinolaringologistas durante atendimentos médicos.
Ele é manuseado durante a otoscopia, exame que permite avaliar as estruturas internas do ouvido para identificar alterações, infecções ou lesões nessa região.
A precisão das análises realizadas com esse equipamento hospitalar depende do modelo utilizado. Vamos entender o que é otoscópio, quais são os principais tipos disponíveis no mercado e como selecionar o modelo ideal para a prática clínica.
O que é otoscópio e para que é utilizado?
O otoscópio é um recurso médico empregado na análise da saúde auditiva do paciente. Ele se assemelha a uma lanterna e conta com uma extremidade cônica, desenhada para se adaptar à estrutura da orelha.
É indicado para identificar condições como infecções (otites), perfurações da membrana timpânica, corpos estranhos no canal auditivo, acúmulo de cera e outras anormalidades. Ele também auxilia na investigação de sintomas como dor de ouvido, sensação de ouvido tampado ou perda auditiva.
Quais são os componentes principais de um otoscópio?
Essa solução é normalmente formado por componentes comuns a todos os modelos, independentemente do seu tipo. Conheça os principais a seguir:
Cabeça
A cabeça do otoscópio é a parte mais visível e funcional do instrumento. Ela é composta pela ocular, lente de aumento localizada na parte superior, e por uma fonte de luz, que ilumina as estruturas internas do ouvido para facilitar a avaliação clínica.
Alça e bateria
A alça é a parte segurada durante o exame. Além de proporcionar ergonomia e firmeza, abriga as baterias que alimentam o sistema de iluminação. Dependendo do modelo, a bateria pode ser recarregável ou descartável.
Espéculo
Os espéculos são acessórios intercambiáveis que se encaixam na cabeça do otoscópio. Eles apresentam um formato cônico e estão disponíveis em diferentes tamanhos, permitindo a troca e a adaptação do dispositivo ao diâmetro do meato acústico de cada paciente.
Como um otoscópio funciona durante um exame?
O exame inicia posicionando a cabeça do otoscópio próximo à entrada do canal auditivo do paciente. Em seguida, ele insere o espéculo no ouvido com cuidado para evitar desconforto ou lesões, especialmente em crianças ou pacientes com sensibilidade na região.
Ao inserir o equipamento, a fonte de luz é acionada, proporcionando iluminação direcionada para o interior do canal auditivo. Nesse momento, é observado através da ocular para analisar detalhadamente o canal e a membrana timpânica.
Após a análise, o equipamento é retirado com cuidado e é possível repetir o processo no outro ouvido.
Quais são os tipos de otoscópios?
Existem diversos tipos de otoscópios disponíveis no mercado, cada um com características e funcionalidades específicas. Conheça a seguir os principais modelos:
Otoscópio de fibra óptica
Esse modelo avançado utiliza fibras ópticas para transmitir luz até o canal auditivo. Ele se diferencia por proporcionar uma iluminação intensa e uniforme, sem sombras ou reflexos.
Isso garante uma visualização clara e detalhada das estruturas do ouvido. Além disso, a fibra óptica é flexível, facilitando a inserção do instrumento e reduzindo o desconforto.
Otoscópio pneumático
O pneumático é indicado para avaliar a mobilidade da membrana timpânica. Isso porque ele possui uma ponta conectada a um bulbo de borracha, permitindo a aplicação de pressão.
Esse exame auxilia no diagnóstico de condições como otite média e disfunção da tuba auditiva.
Otoscópio LED
Como o nome sugere, essa opção se destaca pelo uso de luz LED. Por esse motivo, ele oferece maior potência luminosa, baixo consumo de energia e maior autonomia da bateria. Isso reduz a necessidade de recargas frequentes e melhora a nitidez da visualização durante o exame.
O modelo Pocket Plus LED Onix 22880 é compacto e leve, ideal para diagnósticos precisos. Possui iluminação halógena, que revela a cor verdadeira dos tecidos, além de transmissão de luz fria por fibra óptica, garantindo um campo de trabalho sem sombras e sem aquecimento.
Otoscópio digital
O otoscópio digital representa um avanço tecnológico. Equipado com uma câmera de alta resolução, ele captura imagens detalhadas do canal auditivo e da membrana timpânica com alta precisão e detalhamento visual.
Essas imagens podem ser transmitidas para computadores, smartphones ou monitores, permitindo o armazenamento e o compartilhamento de dados.
Vídeo otoscópio
O vídeo otoscópio é a versão mais avançada disponível atualmente. Ele conta com uma câmera integrada e um monitor de alta definição (HD), que exibe imagens em tempo real. Ele amplia o campo de visão, permitindo uma avaliação minuciosa de estruturas delicadas.
Além disso, possibilita a gravação de vídeos e a captura de imagens, que podem ser armazenadas para análise posterior ou compartilhadas com outros profissionais.
Como escolher o modelo ideal de otoscópio?
Mais do que entender o que é otoscópio, é preciso saber como escolher o modelo certo para a prática clínica. Entenda a seguir o que analisar antes de investir nesse instrumento:
Tamanho do equipamento
Alguns deles estão disponíveis na versão de bolso (pocket), que são mais leves e compactos. Geralmente, eles funcionam com pilhas AA e podem ser transportados com facilidade na bolsa ou no bolso do jaleco.
Já os convencionais são maiores e mais robustos. Embora não sejam tão práticos para transporte, normalmente são mais duráveis, flexíveis e permitem a troca de cabeças e acessórios. Por isso, eles são mais indicados para uso em consultórios ou hospitais.
Tamanho do espéculo
Os espéculos estão disponíveis em diferentes tamanhos, como:
- 4 mm: ideais para adultos e crianças acima de 12 anos;
- 3 mm: para crianças entre 3 e 12 anos;
- 2,5 mm: para bebês e crianças pequenas (até 3 anos);
- 5 mm: para pacientes adultos com canal auditivo mais largo.
O ideal é investir em um que forneça diferentes opções de espéculos ou que permita a compra de tamanhos adicionais.
Bateria
Existem vários tipos de baterias que podem ser utilizadas no equipamento, sendo que as mais comuns são de lítio, NiCd e níquel. A melhor opção é a bateria de lítio, que retém a carga por mais tempo e são mais leves, mas tem um custo mais elevado.
Cabeça
A cabeça é um dos principais componentes, influenciando diretamente sua funcionalidade e custo. O ideal é optar por modelos que permitam a troca dessa peça, aumentando sua versatilidade.
Certificações de segurança
Para garantir a segurança e a eficiência, é fundamental escolher tipos testados e aprovados por órgãos reguladores, como INMETRO e ANVISA.
Essas certificações asseguram que o dispositivo atende aos padrões de qualidade e segurança exigidos para uso médico, garantindo confiabilidade nos exames e proteção ao paciente.
Na MA Hospitalar, você encontra os melhores equipamentos e insumos médicos do mercado, garantindo precisão e segurança na sua prática clínica.
Trabalhamos com equipamentos de alta qualidade, incluindo otoscópios digitais das melhores marcas, como o Welch Allyn®. Entre em contato com nossa equipe ou acesse nossa loja e conheça os produtos!
O aspirador cirúrgico é um equipamento essencial em diversos procedimentos médicos, utilizado para remover fluidos, secreções e sangue da área operada, garantindo visibilidade e segurança durante a intervenção.
Quando atuamos em um hospital, clínica ou até mesmo em casos de cuidado domiciliar, o aspirador cirúrgico pode ser uma das aquisições necessárias para um melhor cuidado.
Mas como saber se esse é o equipamento certo neste momento e em quais situações ele tem aplicabilidade?
Para isso, é preciso saber antes o que é e para que serve um aspirador cirúrgico, pois se trata de uma solução com áreas de aplicação bem amplas.
Se você ainda não conhece o assunto, descubra a importância do aparelho!
O que é um aspirador cirúrgico?
Um aspirador cirúrgico é um dispositivo médico essencial utilizado durante cirurgias para remover fluidos, sangue e outros detritos do campo operatório.
Manter a área de trabalho limpa e visível é crucial para garantir que a cirurgia seja segura e eficaz.
É um equipamento fundamental para a prática cirúrgica!
Onde utilizamos um aspirador cirúrgico?
Esse aparelho é utilizado em vários tipos de cirurgias, desde procedimentos pequenos até cirurgias complexas, como as cardíacas e neurológicas.
É também fundamental na medicina de emergência e em consultórios odontológicos. Afinal, em um cenário intensivo, o controle de secreções é essencial.
Como o aspirador cirúrgico contribui para a segurança do paciente?
A segurança do paciente é sempre uma preocupação durante os procedimentos, e o aspirador cirúrgico ajuda a mitigar riscos.
Ao remover rapidamente sangue e outros fluidos do campo cirúrgico, ele auxilia o cirurgião a trabalhar com maior precisão, desempenhando, assim, um papel significativo na redução de complicações e na melhoria do resultado geral do procedimento.
Ele acaba funcionando como um facilitador para o médico que atua na operação mas também como uma garantia de segurança para o paciente.
Um aspirador eficiente é fundamental para o controle de infecções
O objetivo central de manter o campo cirúrgico limpo envolve não apenas a remoção de fluidos, mas também a prevenção de infecções.
O uso de um aspirador cirúrgico é de vital importância para garantir uma melhor prevenção.
Além disso, ele reduz o risco de infecções após o procedimento, ajudando a promover uma recuperação mais rápida e segura.

Eficiência e mobilidade na aspiração cirúrgica
O ASKIR 118 da CAMI é um aspirador cirúrgico conhecido por sua eficiência, mobilidade e ampla gama de aplicações médicas.
É útil em uma variedade de situações, podendo ser empregado tanto em cirurgias menores quanto em intervenções de emergência, sendo a solução ideal para a remoção segura de fluidos e secreções.
O ASKIR 118 é adequado para uso em diversos procedimentos, incluindo aqueles de pequeno e médio porte, onde a remoção de fluidos é necessária, podendo ser adequado para situações de cuidados domiciliares também.
Com desempenho apropriado em qualquer tipo de situação, ele possui bateria para atender às necessidades de emergências, sendo utilizado em resgates e até mesmo em hospitais, abrangendo diversas áreas e necessidades.
- Saiba sobre o uso do aspirador de secreção no cuidado domiciliar!
Portabilidade e design compacto
Outra grande vantagem do ASKIR 118 é sua portabilidade. Com um design compacto e leve, o aspirador portátil pode ser facilmente transportado para diferentes áreas dentro de um hospital, consultório médico, atendimento domiciliar e ambulância.
Ele também possui um acessório que permite recarregar sua bateria durante o deslocamento na ambulância.
Além disso, oferece facilidade de operação e manutenção, com a possibilidade de ativação sem contato, auxiliando na prevenção de contaminação cruzada.
Possui ainda acessórios como jarra autoclavável e bolsa de transporte.
Encontre na MA Hospitalar a solução que você precisa!
O Aspirador de Secreção Portátil Askir 118 Basic CA-MI é uma ótima escolha para centros cirúrgicos, urgência, emergência e home care, combinando portabilidade, eficiência e segurança.
Seu design e características comportam diversas necessidades, proporcionando um equipamento confiável tanto para profissionais de saúde quanto para cuidadores familiares.
Para saber mais sobre nossos aspiradores cirúrgicos, acesse nossa loja ou entre em contato conosco!
A inserção do PICC é um processo complexo e exige conhecimentos específicos. O enfermeiro é o profissional que com curso de Capacitação/Qualificação pode realizar inserção do PICC.
O cateter venoso central de inserção periférica (Peripherally Inserted Central Catheter — PICC) é um dispositivo intravenoso inserido através de uma veia superficial da extremidade do corpo, que com o auxílio de uma agulha introdutora progride até a veia cava superior ou inferior, apresentando características de um cateter central.
PICC inserido em veia basílica, progredindo em veia cava superior e mantido em posição central no coração.
COMO É FEITO O PROCEDIMENTO?
A inserção do cateter PICC deve contar com técnica de barreira máxima, ou seja, uso de gorro, máscara capote estéril, campos estéreis.
Considerando que o cuidado com o cateter PICC requer uma avaliação contínua — é preciso que o serviço elabore e institua um protocolo de atendimento padronizando as etapas do procedimento para um manejo mais adequado.
MENSURAÇÃO DO CATETER?
O enfermeiro responsável pela mensuração da medida do cateter de PICC deve realizá-la previamente ao início do procedimento, anotando as medidas seguindo conforme o protocolo de atendimento da instituição e padronização.
Necessário medir do local de punção até a posição central, de acordo com a região de escolha para inserção do cateter de PICC.
QUAIS AS ETAPAS DE PLANEJAMENTO DE ENFERMAGEM PARA INSERÇÃO DO CATETER?
- Histórico de enfermagem;
- Avaliação da necessidade do cateter;
- Avaliação da rede venosa;
- Seleção do calibre do cateter;
- Orientação do paciente e/ou responsáveis;
- Vontade do paciente em ter o cateter;
- Termo de consentimento para o procedimento;
- Planejamento do procedimento.
AS PRINCIPAIS VANTAGENS DO PICC SÃO OS BENEFÍCIOS
- Redução do desconforto do paciente, evitando múltiplas funções venosas;
- Possibilidade de ser inserido a beira leito;
- Obter via segura para administração de antibiótico;
- Nutrição parenteral prolongada (NPT);
- Excelente via para quimioterápicos;
- Maior tempo de permanência e menor risco de contaminação em relação a outros dispositivos;
- Preservação do sistema venoso periférico;
- Possível indicação de terapia domiciliar;
- Tem custo inferior ao do cateter venoso central inserido cirurgicamente (CVC);
- Previne complicações de punções periféricas(flebite, infiltração, extravasamento e necrose);
- Reduz stress equipe e paciente.
INDICAÇÕES PARA INSERÇÃO DO CATETER DE PICC
- Por terapia infusional – tipo de droga e duração da Terapia;
- Por critérios clínicos – condições da rede venosa e patologia e estado do paciente.
INDICAÇÕES PARA ADULTOS E CRIANÇAS
- Terapia intravenosa longa;
- Uso de antibióticos, drogas inotrópicas e de terapia de nutrição parenteral NPT;
- Terapia intravenosa vesicante, alta osmolaridade e extremos de PH.
- Uso de quimioterápicos;
- Terapia analgésica;
- É possível realizar coleta de sangue venoso e Mensuração da Pressão Venosa Central (PVC) ambos em cateter com calibre maior que 4Fr sempre respeitando o protocolo padrão da instituição.
INDICAÇÕES PARA NEONATOS
- Terapia intravenosa longa;
- Uso de antibióticos,
- Terapia de nutrição parenteral NPT;
- Terapiaintravenosavesicante, alta osmolaridade e extremos de PH;
- Recém-nascido menor de 1500 gramas.
TERAPIA INTRAVENOSA IV
- Esta terapia é utilizada em pacientes que necessitam de administrações de soluções por via intravenosa, através da via intravenosa administram- se drogas e soluções diretamente no espaço intravascular, ultrapassando assim algumas barreiras de absorção, sendo por esse fato considerada a via mais rápida e perigosa na administração de drogas.
- É necessário que o enfermeiro realize cuidados que promovam a segurança e eficácia da terapia intravenosa. (PEDREIRA E CHAUD, 2003)
ENTÃO QUAIS SÃO AS PRINCIPAIS DIFICULDADES E DESVANTAGENS DO USO DOS PICCS?
- Estão relacionadas à necessidade de uma rede vascular íntegra e calibrosa para o implante;
- Necessidade de treinamento especial para inserção e manutenção do cateter;
- Monitorização rigorosa do dispositivo;
- Necessidade de radiografia para localização da ponta do cateter.
- Evidências demonstraram que o dispositivo não é isento de complicações, tais como trombose venosa profunda (TVP), tromboflebites;
- Oclusões do cateter;
- Pseudoaneurismas arteriais, lesão de uma das camadas do vaso;
- Infecções.
Por outro lado, o emprego do cateter de PICC evita a dissecção venosa e apresenta menor exposição do paciente a dor e complicações inerentes ao procedimento.
CATETER PICC LINHA BLENTA • CATETER PICC MONO LÚMEN POLIURETANO
Observações: A escolha dos tamanhos e comprimentos do cateter varia dependendo do tamanho do vaso de escolha para a punção, geralmente os tamanhos e comprimentos menores são utilizados em neonatal e pediatria, os cateteres de 4F e 5F são tamanhos mais utilizados em adultos, pois são cateteres mais longos, porém vai depender muito da avaliação e comprimento do vaso.
- Calibre: representado pela unidade “french”. É a medida do diâmetro externo do cateter.
- Quanto maior o “french” maior é o calibre do cateter.
APRESENTAÇÕES
São apresentadas nas seguintes dimensões e códigos:
DESCRIÇÃO E COMPOSIÇÃO DO PRODUTO
O Cateter para canalização endovenosa duplo lúmen (PICC) — Blenta é um segmento de poliuretano grau médico radiopaco.
O mesmo é um cateter desenhado para ser inserido perifericamente, através de uma agulha introdutora (introdutor silflash).
O cateter é apresentado em diferentes configurações para os cateteres de duplo lúmen.
As extensões possuem em seu comprimento um clamp para fechamento, e em seu extremo um conector luerlock para conexões standard. Na união do cateter com a extensão se encontra os orifícios para a fixação.
O cateter possui marcações a cada 1cm em seu comprimento e em seu extremo distal possui uma marcação indicativa.
O conector intermitente luerlock que acompanha o conjunto é um conector de segurança, sem agulha e de pressão neutra.
O conjunto é formado pelos componentes abaixo:
Sendo que as características variam de acordo com cada forma de apresentação:
- 01 Cateter para inserção endovenosa duplo lúmen
- 01 Fita métrica
- 01 Pinça metálica
- 01 Garrote de Silicone
- 02 Conectores intermitentes luerlock (segurança)
- 01 Introdutor Silflash.
Acesse nossa loja ou entre em contato para adquirir o seu!
REFERÊNCIAS BIBLIOGRÁFICAS
- JESUS VC, SECOLISR. Complicações acerca do cateter venoso central de inserção periférica (Picc). CiencCuidSaúde. 2007; 6(2): 252-260
- CONSELHO REGIONAL DE ENFERMAGEM. Parecer técnico n° 09 de12dejulho de 2000. Inserção de Cateter Venoso Periférico (PICC) por Enfermeiros. Disponível: http://www.ebah.com.br/content/ABAAAAOTcAK/picc- enfermagem?part=4. Acesso em: 19 de maio de 2014.
- http://www.blentamedical.com/wp-content/uploads/2019/05/Cateter-PICC-Duplo-Poliuretano.pdf
- 5010-01 cateter para canalização endovenosa duplo lúmen
- CAMARGO, Patrícia Ponce de. Procedimento de inserção, manutenção e remoção do cateter central de inserção periférica em neonatos. 2007. Tese de Doutorado. Universidade de São Paulo.
- PEDREIRA, Mavilde da L. G.; CHAUD, Massae Noda. Terapia intravenosa em pediatria: subsídios para a prática da enfermagem. Acta Paul Enferm., v. 17, n. 2, p. 222-228, fev. 2004.
Esse evento pode ocorrer devido a doenças, acidentes automobilísticos ou tumores que acometem as estruturas corporais responsáveis pelo funcionamento do sistema urinário.
Bexiga neurogênica é o termo utilizado quando há uma disfunção na comunicação entre o sistema nervoso central e o sistema urinário, impedindo que o indivíduo tenha controle da micção ou esvaziamento total da bexiga e acarretando várias situações que interferem no dia a dia da pessoa.
FISIOLOGIA DA MICÇÃO
Para entendermos o que ocorre na bexiga neurogênica, precisamos entender a fisiologia da micção:
A bexiga é um órgão oco, distensível e de paredes musculares, que se localiza na região pélvica e tem a função de armazenar a urina antes que ocorra a excreção pela uretra.
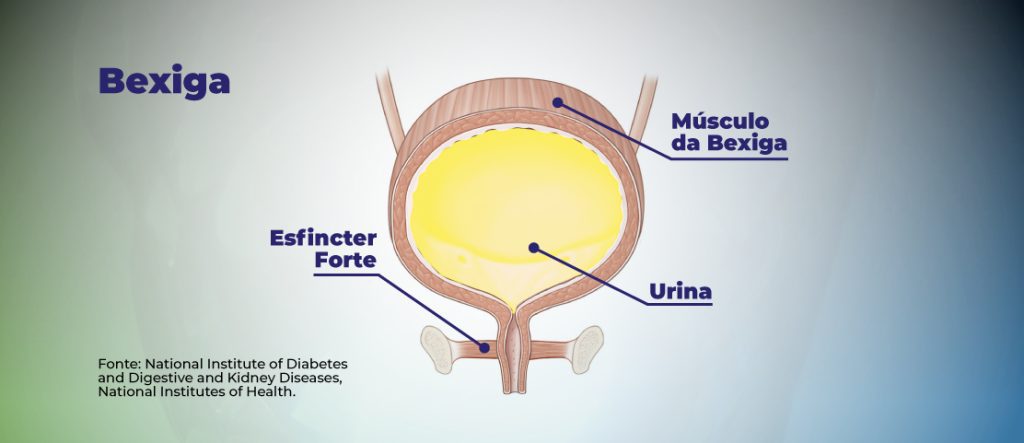
Na medida em que o volume de urina aumenta, as paredes da bexiga se estiram e enviam impulsos sensitivos para o cérebro, que é responsável por enviar impulsos através da medula espinhal e relaxar o esfíncter, permitindo o esvaziamento da bexiga.
Neste caso, se o indivíduo escolher não urinar, o reflexo da micção é inibido, diferentemente de quando há a bexiga neurogênica, que o indivíduo perde o controle desses eventos e a urina pode apresentar escapes ou se manter retida na bexiga trazendo riscos de infecções.
CLASSIFICAÇÕES
Irreversível ou não, a bexiga neurogênica pode ser classificada como hipotônica (flácida), onde a urina preenche toda a cavidade da bexiga e não acontecem os estímulos que devem ser encaminhados ao sistema nervoso central, fazendo com que a urina transborde e haja vazamento involuntário de pequenas quantidades de líquido durante o dia.
Já na bexiga espástica são encaminhados estímulos mesmo quando há pouco ou nenhum volume de urina na bexiga, fazendo com que o indivíduo tenha vontade constante de ir ao banheiro. Também é possível que haja a bexiga mista, onde ocorrem as duas situações descoordenadamente.
CAUSAS
As causas mais comuns da bexiga neurogênica são doenças como diabetes mellitus, tumores da medula espinal ou cerebrais, acidente vascular encefálico, ruptura de disco intervertebral e doenças degenerativas. Acidentes que causam danos a medula espinhal ou traumatismo craniano também podem ser responsáveis por esta condição.
Quando há o esvaziamento incompleto da bexiga, a urina residual pode ocasionar infecções do trato urinário, hidronefrose e entre outras condições graves de saúde.
TRATAMENTO
O tratamento da bexiga neurogênica envolve cateterismo vesical, medicamentos (fármacos é o composto químico/ princípio ativo do medicamento), aumento da ingesta de líquidos e tendo como último recurso, um procedimento cirúrgico.
O QUE É CATETERISMO VESICAL?
O cateterismo vesical é um procedimento que consiste na técnica de introduzir um cateter ou sonda vesical através da uretra até a bexiga, a fim de permitir a saída de urina, podendo ser classificado como permanente ou intermitente.
O cateterismo vesical permanente é um procedimento privativo do enfermeiro, utilizado principalmente em ambiente hospitalar, onde é possível monitorar continuamente a produção de urina, no entanto, esta escolha aumenta o risco de ITU (infecção de trato urinário) e deve ser avaliado criteriosamente todos os dias pela equipe de saúde.
O cateterismo vesical intermitente é considerado o padrão-ouro para o manejo da bexiga neurogênica, segundo guidelines internacionais. Além de ser um procedimento simples e rápido, pode ser realizado pelo próprio indivíduo após alta hospitalar, quando existe a adesão e treinamento adequado sobre o procedimento, que deve ocorrer de forma limpa.
Além dos cateteres convencionais que precisam de lubrificantes para sua utilização, no mercado, existem soluções que tem como objetivo facilitar o manuseio do usuário promovendo a sua autonomia e assim aumentando a adesão de um procedimento realizado de forma segura.
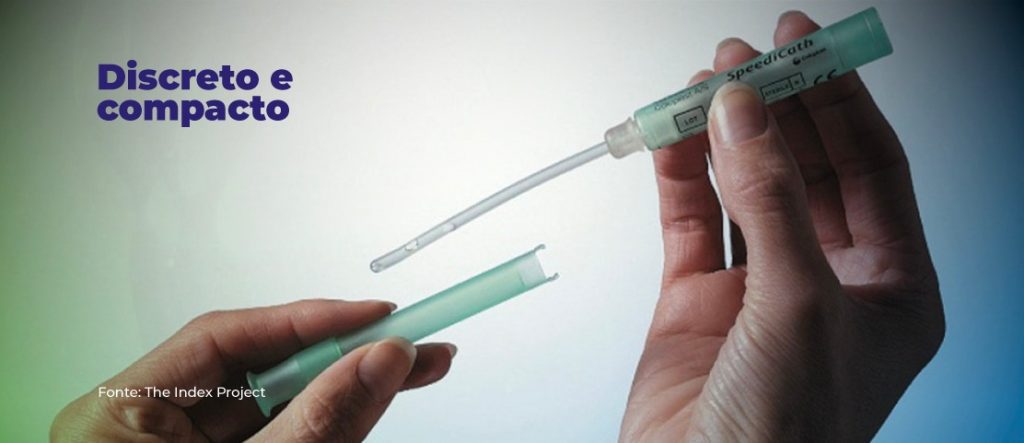
São cateteres avançados, prontos para uso, com revestimento hidrofílico, dispensando o uso de lubrificantes que podem gerar alergias e desconforto. Além disso, são compactos, discretos e podem ser levados para qualquer lugar, evidenciando a independência e autoconfiança dos usuários.
CONHEÇA A FAMÍLIA SPEEDICATH®
A linha Speedcath® oferece cateteres avançados que fornecem uma solução suave graças a duas características exclusivas: revestimento hidrofílico único, que mantém a parede do cateter suave e uniforme do início ao fim do procedimento, e ofícios polidos, que asseguram que a mucosa deslize suavemente pelo orifício, minimizando riscos de danos e traumas a uretra.
Além de características exclusivas, a linha Speedicath® traz um portfólio de soluções para cada pessoa, oferecendo opções de cateteres mais discretos e compactos que podem ser transportados até mesmo no bolso, para qualquer lugar, e ainda assim serem utilizados com segurança e efetividade.
A linha ainda disponibiliza um cateter avançado com guia de inserção — para lidar com os desafios anatômicos da uretra masculina.


Esta solução e muitas outras estão disponíveis na MA Hospitalar. Entre em contato ou acesse nossa loja e conheça nossa linha para ostomias!
REFERÊNCIAS
- https://www.msdmanuals.com/pt-br/profissional/distúrbios-geniturinários/distúrbios-miccionais/bexiga-neurogênica
- https://www.medicinanet.com.br/conteudos/revisoes/2022/bexiga_neurogenica.htm
- POTTER, Patrícia A; PERRY, Anne G. Fundamentos de enfermagem. Ed. 8ª. Rio de. Janeiro: Elsevier, 2013.
- EAUGuidelines2009,Stöhreretal.Europeanurology56(2009)81-88.
A Organização Mundial de Saúde (OMS) recomenda a nomenclatura de pré-termos ou prematuros para crianças que nascem com idade gestacional menor que 37 semanas, situação que, anualmente, atinge 15 milhões de crianças ao redor do mundo.
No Brasil, cerca de 12% dos nascidos vivos são oriundos dessas gestações. A porcentagem corresponde a aproximadamente 360 mil crianças ao ano, quase mil ao dia, no País.
Um outro dado, desta vez do Fundo das Nações Unidas para a Infância (Unicef) e do Ministério da Saúde, mostra que, no Brasil, 11,7% de todos os partos ocorrem antes do tempo.
Segundo determinação da OMS, duas classificações de grande importância devem ser empregadas aos recém-nascidos para se identificar às condições físicas e, até mesmo as relacionadas com a maturação.
A primeira está relacionada à idade gestacional do recém-nascido, que são classificados como: pré-termo, aquele com menos de trinta e sete semanas de idade gestacional; a termo, aquele entre trinta e sete e quarenta e uma semanas e seis dias de idade gestacional, ou pós termo, aqueles com quarenta e duas semanas ou mais de idade gestacional.
A outra classificação é quanto ao peso, onde acima de quatro quilos considera-se uma macrossomia, entre dois quilos e meio e menos de quatro quilos considera-se normal, com menos de dois quilos e meio considera-se baixo peso, e com menos de um quilo e meio considera-se muito baixo peso.
POR QUE ACONTECE?
Existem alguns motivos para bebês nascerem antes do tempo — a prematuridade é um fenômeno multifatorial e, em muitos casos, é difícil identificar uma causa exata. Existem diversos fatores que podem resultar no nascimento prematuro.
A ausência dos cuidados de pré-natal é um dos principais. Além deste, o tabagismo, o alcoolismo, o uso de entorpecentes, o estresse exacerbado, as infecções urinárias, o sangramento vaginal, o diabetes, a obesidade, a hipertensão e a gravidez gemelar são causas frequentes para o parto prematuro.
COMO PREVENIR?
O segredo para reduzir os riscos de ter um bebê prematuro está no bom acompanhamento médico durante o pré-natal. Buscar conselhos de um profissional de medicina de confiança antes mesmo da gravidez e seguir um estilo de vida mais saudável é uma opção recomendável.
Além disso, o pré-natal deve ser iniciado imediatamente após a confirmação da gravidez. A história clínica, as consultas e os exames, bem como o monitoramento médico constante, são os passos necessários para evitar a complicação.
PROBLEMAS RELACIONADOS COM A PREMATURIDADE
O recém-nascido prematuro, devido à imaturidade de seus órgãos e sistemas, pode desencadear vários problemas resultantes da sua dificuldade de adaptação extra-uterina.
O sistema respiratório dos prematuros tende a adaptar-se mal à respiração do ar ambiente e manifestar uma depressão respiratória logo na sala do parto, bem como há uma susceptibilidade maior ao desencadeamento de displasia broncopulmonar, doença da membrana hialina, apneia da prematuridade e síndrome de Mikity-Wilson (caracteriza-se por blebs e bolhas de enfisema pulmonar com alvéolos de paredes espessadas.
Manifesta-se por incapacidade de ventilação pulmonar normal acompanhada de hipóxia).
Os prematuros correm risco de ter problemas neurológicos, tais como a hemorragia intracraniana e a depressão perinatal.
No sistema cardiovascular pode estar presente a hipotensão, a hipovolemia, e, até mesmo, uma insuficiência cardíaca congestiva.
Problemas metabólicos, tais como a hipoglicemia, hipocalcemia, acidose metabólica e osteopenia da prematuridade, são comuns em recém-nascidos prematuros.
Os recém-nascidos prematuros necessitam de uma atenção especial quanto ao tipo, à quantidade e à via de alimentação, uma vez que seu sistema digestório encontra-se imaturo. Deve-se ter cuidados com relação à prevenção da enterocolite necrosante.
A anemia e a apresentação da hiperbilirrubinemia são problemas hematológicos frequentes em prematuros.
Os rins imaturos caracterizam-se por apresentar uma deficiência na filtração glomerular e uma dificuldade de metabolizar volumes de água, solutos e ácidos (MEDSI; STARK, 2000).
Os prematuros são especialmente susceptíveis a hipotermia e a hipertermia, caracterizando-se, então, em uma imaturidade do mecanismo de regulação térmica.
O sistema imunológico apresenta uma deficiência tanto na resposta humoral quanto celular, o que aumenta a vulnerabilidade de infecções em prematuros. Problemas oftalmológicos, como a retinopatia da prematuridade, pode desenvolver-se.
A TERAPIA VENOSA PARA O DESENVOLVIMENTO DO RN
Diariamente, inúmeros procedimentos são realizados nas Unidades de Terapia Intensiva Neonatal, sendo parte de estratégias terapêuticas que têm como finalidade garantir a sobrevida dos recém-nascidos (prematuros ou a termo). Muitos desses procedimentos são invasivos e dolorosos.
O neonato reage a esses estímulos nociceptivos de forma que frequentemente trazem alterações respiratórias, cardiovasculares, endócrino-metabólicas que podem resultar no aumento da morbimortalidade neonatal.
Uma das áreas de grande atuação dos profissionais de enfermagem é a terapêutica intravenosa. Devido à necessidade de o neonato ter acesso venoso por tempo prolongado e à administração de drogas irritantes ou vesicantes, soluções hiperosmolares, nutrição parenteral, antibioticoterapia que repercute em repetidas punções venosas periféricas no decorrer da internação, o tratamento pode se prejudicar devido ao risco de o bebê ficar sem acesso.
A imaturidade do sistema vascular faz com que os acessos venosos sejam perdidos com grande frequência, trazendo como consequências a interrupção da terapêutica adotada e os danos secundários ao extravasamento de soluções.
Além disso, há um maior risco de infecção nestes pacientes, devido às inúmeras punções venosas que são realizadas. Todos estes fatores geram estresse e dor no neonato, contribuindo para uma recuperação mais lenta e um maior tempo de internação hospitalar.
Para evitar tal situação, muitas vezes será necessária a instalação de um cateter venoso central como umbilical, dissecção de veia ou passagem de cateter venoso central de inserção periférica (PICC).
O PICC vem sendo uma alternativa adotada nas unidades de terapias neonatais para a manutenção de acesso venoso profundo e prolongado nos recém-nascidos de alto risco. A inserção do cateter é um procedimento realizado por enfermeiros com treinamento e habilitação exigida por lei conforme Resolução COFEN 258/2001.
O PICC é um dispositivo inserido por uma veia periférica, que migrará até a veia cava superior ou inferior e que apresenta baixos riscos de infecção e de complicações desde o momento da inserção até a sua retirada.
A cateterização intravenosa permitiu o desenvolvimento de novas técnicas diagnósticas e tratamentos especializados, sendo adotados com grande frequência nas UTIN para cuidados intensivos e semi intensivos para neonatos prematuros extremos, oferecendo um precioso suporte na monitorização hemodinâmica, hemodiálise, administração de nutrição parenteral total (NPT), líquidos, quimioterápicos, infusão de sangue e hemoderivados, antibioticoterapia prolongada, pacientes submetidos a certos procedimentos cirúrgicos, portadores de malformações e síndromes.
Sua contra indicação está relacionado à recém-nascidos com lesão/infecção cutânea próxima ao local de inserção; em neonatos com edema ou dissecção venosa prévia; nos casos de alteração anatômica, que interfiram na progressão do cateter; em pacientes com policitemia, pelo risco de obstrução do cateter; e se houver recusa dos pais.
Os PICC podem ser compostos com lúmen único ou duplo lúmen, constituído de poliuretano ou silicone, são hemocompatíveis e menos trombogênicos dificultando a adesão de microrganismos em suas paredes, o que permite uma permanência prolongada.
Portanto, a escolha do cateter periférico de inserção central para o tratamento da prematuridade traz benefícios não somente para os neonatos e suas famílias, mas também para as instituições de saúde, que terão menores índices de infecção hospitalar e uma maior satisfação dos clientes.
Quer saber mais sobre nossos cateteres, entre em contato ou conheça nossa loja!
REFERÊNCIAS BIBLIOGRÁFICAS
- https://www.gov.br/pt-br/noticias/saude-e-vigilancia-sanitaria/2020/11/data-marca-importancia-do-cuidado-com-o-prematuro
- https://www.sbp.com.br/imprensa/detalhe/nid/departamento-cientifico-de-neonatologia-da-sbp-divulga-publicacao-com-enfase-na-prevencao-da-prematuridade/
- https://chniteroi.com.br/pt/sobre-nos/blog/prematuridade-entenda-o-que-e-suas-causas-e-como-prevenir
- https://siteantigo.portaleducacao.com.br/conteudo/artigos/enfermagem/caracterizando-recem-nascidos-submetidos-a-insercao-do-picc/10344
A pandemia da Covid-19 trouxe à tona algo antes restrito a centros cirúrgicos, UTIs ou pronto-atendimentos.
Nunca se discutiu tanto sobre intubação, como nos últimos anos.
Medicações como sedativos e bloqueadores já são assuntos conhecidos por grande parte da população.
Na publicação IOT você sabe o que é? em nosso blog, está bem explicada qual a sua indicação!
Mas o que iremos abordar agora é como podemos proteger a via aérea do paciente, assim como a equipe de atendimento local.
E COMO FICA A FILTRAÇÃO, AQUECIMENTO E UMIDIFICAÇÃO DO SISTEMA RESPIRATÓRIO?
Quando a intubação orotraqueal é necessária, durante o suporte ventilatório, os mecanismos fisiológicos de aquecimento e umidificação do ar inspirado são suprimidos.
Estas funções, em situações de normalidade são exercidas pelo nariz e faringe (via aérea superior) principalmente, estendendo-se até aproximadamente o final da traqueia.
Então, o condicionamento dos gases inspirados é imprescindível, com o objetivo de proporcionar conteúdo de água e calor similar ao usualmente proporcionado pelas vias aéreas superiores.
De maneira artificial as tarefas de umidificação e aquecimento também podem ser realizadas por meio de trocadores de calor e umidade passivos (HME — Heat and Moisture Exchangers)1,5. Além destas funções, esses dispositivos funcionam como filtros de partículas, viral e bacteriano.
POR QUE UTILIZAR?
O uso de dispositivos passivos que proporcionam calor e umidade previnem hipotermia, lesão epitelial, por lesão do tecido ciliar (tecido que recobre a nasofaringe, responsável pela compactação das partículas de “sujeira”), espessamento do muco, broncoespasmos, obstrução da via aérea, e em casos piores, oclusão do tubo traqueal2,3.
Estas complicações podem levar a uma piora do estado de saúde do paciente, ou até mesmo eventos adversos.
COMO FUNCIONA
Os filtros contém uma membrana denominada higroscópica, que é constituída de camadas de material com baixa condutividade térmica (papel ou espuma), impregnada ou não com sais higroscópicos (usualmente cloreto de cálcio ou lítio) e à medida que o paciente exala ar quente e úmido, a membrana higroscópica do HME captura calor e umidade em forma de condensação.
Quando o paciente inala, o HME devolve calor e a umidade do gás inspirado à medida que a condensação se evapora para formar gás de água.
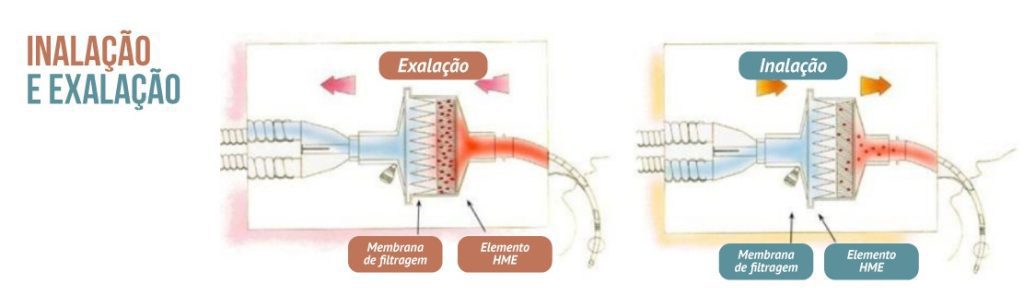
Por isso é denominado passivo — não há necessidade de fonte de energia para o aquecimento e nem a adição de água. O calor e umidade gerados pelo organismo, que irão proporcionar a umidificação e aquecimento do ar que está vindo do ventilador mecânico ou máquina de anestesia, inalado pelo paciente.
Por isso, também, a importância da manutenção da temperatura corporal adequada do paciente durante os procedimentos cirúrgicos, nas UTI e pronto atendimentos.
Mas se retém umidade, essa água pode passar para o lado da traqueia e ir para o interior dos equipamentos, ou ficar acumulada e atrapalhar a ventilação do paciente?
A resposta é NÃO!
Após a membrana higroscópica, há outra filtrante eletrostática totalmente hidrofóbica eliminando a probabilidade da passagem de condensado para o circuito.
COMO AVALIAR A EFICÁCIA DE UM FILTRO HME
Para se obter uma melhor umidificação sem oferecer riscos aos pacientes, é recomendado pela American National Standards Institute e American Association for Respiratory Care (AARC) umidade absoluta ≥ 30 mg H2O/L fornecidos pelos dispositivos HME3.
Com isso, um dos requisitos para se avaliar a eficiência de um dispositivo passivo, está de acordo com a capacidade de retorno da umidade que este oferece.
Em um estudo em que se avaliou 48 dispositivos, foram comparados os dados do fabricante com os dados obtidos de acordo com os testes baseados no ISO 9360. O filtro Higrobac S apresentou o valor de umidade absoluta acima do recomendado, isto é 31,2±0,24.
Outro estudo que analisou 8 diferentes filtros, os níveis de umidade e temperatura foram medidos durante a situação controle (nenhum HME) e com os diferentes HMEs quando, volume corrente, frequência respiratória e fluxo foram variados.
A recuperação da umidade absoluta da expiração durante a próxima inspiração (% RAH) foi calculada. A % RAH aumentou com o uso do HME comparado ao controle. O Hygrobac S apresentou o melhor resultado comparado com os outros dispositivos6.
Nesse mesmo estudo verificou-se que o aumento do EtCo2 (fração expirada final de dióxido de carbono) foi proporcional ao aumento do espaço morto dos HME.
FILTRAÇÃO ELETROSTÁTICA
Já falamos da importância do aquecimento e retorno de umidificação e quais os níveis adequados de desempenho, mas e a filtração? Como ela ocorre e o que devemos analisar para adquirir um dispositivo seguro?
A membrana hidrofóbica de polipropileno passa por um campo de energia elétrica durante sua fabricação, por isso o nome Eletrostática.
Essa camada de fibras aleatórias captará as partículas através de cargas de energia, e o quanto de cargas retidas e seus diâmetros, que um bom filtro é capaz de reter, é a chave para o sucesso de proteção do paciente e sua equipe.
EFICIÊNCIA DE FILTRAÇÃO BACTERIANA E VIRAL
A eficiência de filtração é sempre avaliada para bactérias e vírus. Estes testes devem ser certificados por laboratórios independentes, e proporcionar ao usuário a comprovação destes resultados.
Segue como devemos ler estes dados:
BFE (eficiência de filtração bacteriana) / VFE (eficiência de filtração viral)
- BFE= 99% = passagem de 1 micro-organismo cada 100
- BFE= 99.9% = passagem de 1 micro-organismo cada 1,000
- BFE= 99.99% = passagem de 1 micro-organismo cada 10,000
- BFE= 99.999% = passagem de 1 micro-organismo cada 100,000
- BFE= 99.9999% = passagem de 1 micro-organismo cada 1,000,000
Podemos então entender que quanto mais “9” depois da vírgula, mais eficaz o filtro!
O Higrobac S apresenta teste de eficiência comprovado pelo laboratório Nelson7. A capacidade de filtração encontrada foi de 0,02 micras. Assim patógenos como Ortomixovirus – H1N1, Pneumocytis, Mycobacterium tuberculosis e Virus da Hepatite B, são retidos com eficiência na membrana do Higrobac S.
CHECKLIST
Agora podemos ver que filtros HME não são todos iguais, e exigir as evidências de desempenho é parte importantíssima para a decisão do melhor produto!
O filtro Higrobac S tem sua eficiência comprovada através de estudos independentes — e publicados nas revistas internacionais de maior renome. Com um portfólio que atende desde pacientes neonatais até adultos, proporciona a segurança que seu paciente e equipe buscam.
Exigir evidências como laudos da capacidade de filtração é um passo importante para a seleção adequada de um dispositivo tão importante.
Conheça também os nossos modelos de filtros. Entre em contato com a MA Hospitalar!
REFERÊNCIAS
1. AMIB. Diretrizes Brasileiras de Ventilação Mecânica -2013.
2. Chandler, M. Measurement of heat and moisture exchanger efficiency. Anaesthesia 2013, 68, 953-960.
3. Restrepo et al. Humidification During Invasive and Noninvasive Mechanical Ventilation: 2012. AARC Clinical Practice Guideline. Respir Care 2012; 57 (5): 782-788.
4. Lellouche at al. Humidification Performance of 48 Passive Airway Humidifiers: Comparison with Manufacturer Data. Chest 2009; 135 (2) 276-286.
5. Lucato et al. Evaluating Humidity Recovery Efficiency of currently Available Heat and Moisture Exchangers: A Respiratory System Model Study. Clinics 2009; 64 (6):585-90.
6. Lucato et al. Evaluation of Resistence in 8 Different Heat-and- Moisture Exchangers: Effects of Saturation an Flow Rate/Profile. Respir Care 2005; 50 (5): 636-643.
7. Nelson Laboratories, Salt Lake City, UT, USA.
A Intubação Orotraqueal (IOT) é uma das técnicas mais antigas da medicina capaz de garantir uma via aérea definitiva.
A traqueostomia já havia sido descrita antes da Era Cristã pelo grego Asclepíades. A intubação traqueal, por sua vez, só foi descrita séculos depois. A primeira descrição conhecida cabe a Andreas Vesalius em 1543, realizada em animais em um modelo de pneumotórax.
Vesalius pode ser considerado um homem muito além do seu tempo, pois tinha observado a interação do sistema cardiorrespiratório.
O médico William Macewen, em 1878, foi o primeiro a realizar uma intubação traqueal, sendo que a primeira laringoscopia direta foi descrita em 1895 por Kirsten. Chevalier Jackson foi o primeiro a introduzir o uso de baterias ao laringoscópio e recomendar a introdução do equipamento pelo lado direito da rima oral (abordagem paraglossal).
Magill postulou que quanto maior a lateralização da laringoscopia melhor seria a visibilização da laringe.
Por fim, coube a Robert Macintosh descrever o laringoscópio com lâmina curva em 1943. No entanto, sua grande inovação foi a técnica que envolvia a introdução da ponta romba da lâmina na valécula, pressionando o ligamento glosso-epiglótico, fletindo anteriormente a epiglote e expondo a glote.
Esta técnica definiu o procedimento padrão da intubação orotraqueal descrita até hoje.
O desenvolvimento do laringoscópio com diferentes tipos de lâminas possibilitou a colocação do tubo sem a traqueostomia. Com o passar dos anos, as técnicas foram aprimoradas, com uso de drogas para intubação, assim como a tecnologia oferecida.
O avanço de cânulas, dos tubos de O’Dwyer até chegar ao laringoscópio levou mais de 100 anos de estudos e testes.
Atualmente, podemos encontrar diversos recursos para intubação de via aérea no mercado, entre eles videolaringoscópio — onde é possível detalhar, visualizar e intubar o paciente de forma muito mais segura e eficaz.
Intubação orotraqueal, ou IOT, é um procedimento médico que visa estabelecer o controle definitivo da via aérea. Esse procedimento é comumente realizado em pacientes nas unidades de emergências, unidades de terapia intensiva e nas salas de cirurgia.
Atualmente é um tema bastante difundido na mídia devido a pandemia, muito se conheceu dessa matéria de suas necessidades e dificuldades, mas temos o devido conhecimento a respeito ou sabemos dos avanços tecnológicos existentes no mercado?
Mas o que é intubação e sua indicação?
É um procedimento médico caracterizado introdução de um tubo específico pelo trajeto da via aérea superior (boca – laringe – traqueia) do paciente, utilizando o laringoscópio ou videolaringoscópio para visualização da laringe e cordas vocais, com posterior passagem do tubo pelo trajeto.
Este instrumento possui lâminas curvas ou retas para introdução na boca para passagem do tubo. É realizado em toda situação em que é necessário manter uma via aérea patente e segura.
Desse modo, as indicações de intubação traqueal recaem sobre aqueles pacientes que necessitam manter as vias aéreas permeáveis e o controle da ventilação pulmonar.
O procedimento pode ter caráter eletivo ou de emergência. A indicação de modo eletivo fica reservada principalmente nos pacientes submetidos a cirurgia, sendo uma decisão de anestesistas e endoscopistas e em emergências como parada cardiorrespiratória, insuficiência respiratória, hipoventilação, choque, coma, pós-operatório e politraumatismo.
É possível, dentro do quadro clínico, considerar que todo paciente que necessita de suporte ventilatório através de ventilação pulmonar mecânica tem indicação de intubação traqueal.
Reconhecer uma via aérea, é fácil?
Reconhecer uma via aérea é um dos principais desafios no momento da intubação e o bom reconhecimento com alta tecnologia colocada à disposição pode ser determinante no desfecho em tentativas de intubação.
Segundo a Sociedade Americana de Anestesiologia, via aérea difícil é uma situação clínica em que um anestesista convencionalmente treinado apresenta dificuldades em aplicar a ventilação com máscara facial, dificuldade para intubação traqueal, ou ambos. A via aérea difícil representa uma interação complexa entre fatores do paciente, cenário clínico e habilidade de quem realiza o procedimento.
Dentre os fatores do paciente, existem sinais clínicos óbvios que predizem a dificuldade da intubação traqueal, particularmente malformações, tumores e traumas faciais.
Existem escalas muito utilizadas com esse fim, entre elas por exemplo a classificação de Mallampati, que gradua a via aérea em 1 à 4, sendo 4 a classificação com maior dificuldade para IOT. Sendo a classe 3 e 4 as mais difíceis de realizar a intubação, devido a pouca ou quase nenhuma abertura de via aérea.
Técnica e preparo
A curva de aprendizagem para a laringoscopia e a intubação apresenta dificuldades inerentes ao procedimento. Mulcaster et col estudaram a evolução a aquisição da habilidade no procedimento por médicos recém iniciados na carreira e mais inexperientes e determinaram que, em média, 47 intubações são necessárias para que atingir a probabilidade de 90% de sucesso no procedimento.
Benumof descreveu que a adequada tentativa de intubação deveria apresentar seis componentes: ser realizada por médico com razoável experiência, ter o paciente com relaxamento da musculatura, posicionamento ótimo para laringoscopia (posição de “cheirador”), manipulação da laringe externamente, apropriado comprimento da lâmina do laringoscópio e tipo de lâmina.
Dentro desses princípios, a laringoscopia deve ser executada com sucesso já na primeira tentativa, não se devendo ultrapassar três tentativas no máximo.
A laringoscopia deve ser realizada pelo médico em uma posição confortável. É necessário ajustar a altura que se encontra o paciente para a altura do médico trazendo a via aérea do paciente para dentro do seu campo visual central.
A posição ideal para a laringoscopia é controversa. Enquanto Jackson defende a hiperextensão da cabeça, Magill recomenda a posição de “cheirador” com a flexão do pescoço em direção ao tronco seguindo leve extensão da cabeça. Há evidência clínica da importância da posição de “cheirador”.
A manobra de extensão da cabeça facilita a inserção do laringoscópio e reduz o contato entre o laringoscópio e os dentes maxilares, melhora a visão da laringe e é essencial para a abertura total da boca.
A diferença básica entre as técnicas utilizando a lâmina curva e a reta é que a curva teria um maior controle da língua no procedimento, além disso, a lâmina curva pressiona o ligamento glosso-epiglótico para fletir anteriormente a epiglote enquanto a lâmina reta eleva diretamente a epiglote.
Complicações do manejo ao intubar
Entre as complicações existentes estão lacerações dos lábios, da língua, da faringe; luxações dentárias; dor de garganta; edema e espasmo da glote.
Muitas ocorrem com sintomas leves e de curta duração. Entretanto, em muitos casos as lesões são graves e permanentes, envolvendo as estruturas da laringe e da traqueia, e exigem correção cirúrgica. Em pacientes obesos a incidência de dificuldades na intubação gira em torno de 13%.
Esses problemas são causados pela presença de depósitos gordurosos em face, região malar, tórax, língua, e pelo pescoço curto com excesso de tecidos moles em palato, faringe e região superior e anterior da laringe.
Intubação no Brasil
Infelizmente com o avanço da COVID-19, tivemos muito mais informações a respeito desses casos de intubação ou da necessidade de intubação. Podemos ter uma ideia alarmante dessa necessidade devido aos noticiários diários no país.
As UTIs ficaram semanas lotadas de pacientes com COVID-19 no Brasil, especificamente no RS, a necessidade de leito passou de 100% de lotação em Porto Alegre, Caxias do Sul e Pelotas como exemplo, nesse ponto não há distinção se é internação público ou privado.
Conferindo o site https://covid.saude.rs.gov.br/ a taxa de internação no dia 22/04/2021 de leito privado no RS é de 98,2% e do SUS é de 80,9%. Bem provável que a grande maioria desses pacientes precisaram ser intubados.
A AMIB (Associação de Medicina Intensiva Brasileira) relata em uma reportagem, veiculada no site O Globo, a necessidade de intubação nas UTIs públicas também foi maior. Nelas, 63,8% dos pacientes precisaram de ventilação mecânica.
Na rede privada, o índice foi de 39%. Mais da metade dos pacientes que precisaram de intubação ficaram em ventilação mecânica por mais de 7 dias. De forma geral, esse índice foi de 55,7%. No SUS, o índice foi de 50,3%; na rede privada, 59,3%.
Segundo a AMIB, há em torno de 47 mil leitos de UTI no Brasil, sendo 32 mil só para pacientes adultos, maiores casos de covid-19. Estes dados não dizem exatamente quantos pacientes necessitaram de intubação, mas é prática em estados críticos como COVID-19 em ambiente de UTI, realizar a intubação para necessidade de suporte ventilatório, sendo uma taxa alta.
A AMIB como forma educativa e de orientação, traz documentação oficial “Orientações no Manejo do paciente com Insuficiência Respiratória por COVID-19”.
Neste documento é relatado abordagens como de Oxigenioterapia de forma racional; Uso de Ventilação Não Invasiva com Pressão Positiva na COVID-19; Uso de Cateter Nasal de Alto Fluxo na COVID-19; Manejo de Ventilação Invasiva no Paciente com COVID-19; Monitorização da Ventilação Invasiva no Paciente com COVID-19 Retirada da Ventilação Mecânica no Paciente com COVID-19.
Temos tecnologia para uma intubação melhor?
O laringoscópio ainda é utilizado como meio de intubação mais tradicional e requer muito esforço, treinamento e bom manejo do equipamento na via aérea do paciente, contudo com o avanço da tecnologia em diferentes áreas do conhecimento, um procedimento que é rotineiro que é a intubação teve um grande salto em tecnologia.
Hoje já é possível intubar sem a necessidade de muito esforço, com precisão e visualização da via aérea em tempo real.
A MA Hospitalar possui em dispositivo ergonômico, de fácil manuseio e eficaz na intubação de via aérea, inclusive em via aérea difícil, que é o videolaringoscópio VS10, que permite ao médico a tradicional visão direta, aliada a um aumento no ângulo de visão indireta sem sofrer alteração na técnica de intubação, e com lâmina fina para menor interação dental.
Recomendação AMIB
Dentre seus anexos na recomendação “estratégias excepcionais para a redução de consumo sedativos, opioides e bloqueadores neuromusculares (BNM) essenciais em pacientes com COVID-19” em nova recomendação publicado em 22/03/21, no seu protocolo de preparação de intubação, há como um dos materiais recomendados o videolaringoscópio, sendo de grande importância no momento estressante que é a intubação e com o devido reconhecimento da AMIB, como material necessário e recomendado como essencial neste momento que vivemos.
Esse tipo de recomendação, só reforça a preocupação que a entidade tem em aperfeiçoar o manejo e a conduta no momento da intubação, que pode ser crucial no desfecho do paciente. Um recurso como videolaringoscópio pode salvar vidas na velocidade da necessidade de suporte ventilatório e em pacientes graves e com dificuldades de abertura de via aérea.
Intubar é seguro?
Sim! É o meio mais utilizado para suporte ventilatório crítico, considerada como método avançado de suporte à vida do paciente. O ato de intubar não quer dizer que o paciente pode ter um desfecho negativo ou preservado, mas sim a sua condição clínica pode levar a um pior desfecho.
Devemos sim, buscar sempre melhores condições tecnológicas para que o ato de intubar seja seguro, que evite traumas ao paciente e de alta performance para a equipe clínica, que a condução seja mais rápida possível sem intercorrências. Não tenha medo, intubar é seguro e pode salvar vidas.
Conheça o videolaringoscópio VS10 na nossa loja ou entre em contato conosco!
A tireoide é um órgão que muitas pessoas não se atentam a fazer revisões e ver se está tudo indo bem.
Vamos falar um pouco sobre esse órgão tão importante, conhecer suas funções e entender como podemos tratar caso tenhamos algum problema?
O QUE É A TIREOIDE?
A glândula tireoide é um órgão que está localizado na parte anterior do pescoço, abaixo da cartilagem tireoide, na frente da traqueia. Na maioria das pessoas a tireoide não pode ser vista nem sentida. A tireoide tem forma de H, com 2 lobos, o lobo direito e o lobo esquerdo, unidos por uma parte estreita denominada istmo.
FUNÇÕES
Ela é a controladora mestre do metabolismo, exercendo um papel essencial na nossa saúde e bem-estar. Ela produz, armazena e secreta hormônios da tireoide no sangue, regulando o metabolismo. Ela produz os hormônios T3 (triiodotironina) e T4 (tiroxina).
PARA QUE SERVEM O T3 E O T4?
T3 e T4 são hormônios produzidos pela glândula, sob estímulo do hormônio TSH que também é produzido pela tireoide, e que participam de diversos processos no organismo, principalmente relacionados com o metabolismo e fornecimento de energia para o bom funcionamento do corpo.
Entre as doenças mais comuns relacionadas estão o hipertireoidismo, quando a tireoide produz hormônio em excesso, e o hipotireoidismo, quando a glândula não produz hormônio suficiente para as necessidades do corpo.
A alta produção hormonal pode levar a perda de peso, alteração de apetite, taquicardia, fadiga e alteração da menstruação. Já a baixa produção provoca metabolismo mais lento e causa ganho de peso, cansaço, lentidão no funcionamento do intestino, sonolência e anemia.4
SÍNTESE E LIBERAÇÃO DO T3 E T4 – EXPLICAÇÃO CIENTÍFICA
A síntese dos hormônios tireoidianos requer. O iodo, ingerido na alimentação e na água como iodeto, é ativamente concentrado pela glândula e convertido em iodo orgânico (organificação) dentro das células foliculares pela peroxidase tireoidiana.
As células foliculares circundam um espaço preenchido por coloide, que consiste em tireoglobulina, uma glicoproteína que contém tirosina em sua matriz. A tirosina em contato com a membrana das células foliculares é iodada em 1 (monoiodotirosina) ou 2 (di-iodotirosina) locais e depois acoplada para produzir 2 formas de hormônio tireoidiano.
- Di-iodotirosina + di-iodotirosina → T4
- Di-iodotirosina + monoiodotirosina → T3
T3 e T4 permanecem incorporados à tireoglobulina dentro do folículo, até que as células foliculares captem a tireoglobulina sob forma de gotas de coloide. Uma vez no interior das células foliculares, T3 e T4 são clivadas a partir da tireoglobulina.
T3 e T4 livres são então liberados na corrente sanguínea, onde se ligam às proteínas séricas para seu transporte. A proteína transportadora primária é a globulina ligadora tiroxina (GLT), com alta afinidade, porém baixa capacidade de ligação de T3 e T4. A TBG normalmente transporta 75% dos hormônios tireoidianos ligados.
As outras proteínas de ligação são
- Pré-albumina de ligação a tiroxina (transtiretina), que tem alta afinidade, mas baixa capacidade para T4.
- Albumina, que tem baixa afinidade, mas alta capacidade de se ligar ao T3 e T4.
Aproximadamente 0,3% da T3 sérica total e 0,03% da T4 sérica total se encontram na forma livre, em equilíbrio com os hormônios ligados. Apenas T3 e T4 livres estão disponíveis para atuar nos tecidos periféricos.
Todas as reações necessárias para a formação e liberação de T3 e T4 são controladas pelo TSH, que é secretado pelas células tireotróficas pituitárias.
A secreção de TSH é controlada por um mecanismo de retroalimentação negativa na hipófise: o aumento das concentrações de T4 e T3 livres inibe a síntese e a secreção de TSH, ao passo que concentrações mais baixas incrementam a secreção de TSH.
A secreção de TSH também é influenciada pelo TRH, que é sintetizado no hipotálamo. Os mecanismos precisos que regulam a síntese e liberação de TRH não estão claros, embora a retroalimentação negativa dos hormônios tireoidianos iniba a síntese de TRH.
A maior parte da T3 circulante é produzida fora da tireoide pela monodesiodação de T4. Apenas um quinto da T3 circulante é secretada diretamente pela tireoide.
BEM COMPLEXO, NÃO É MESMO?
Mas o importante é sabermos que a tireoide regula muitas funções importantes do organismo e precisamos cuidar dela, como cuidamos de outros órgãos essenciais!
Alguns exames laboratoriais são importantes de se adequar no check up médico, como rotina, para verificar as funções da tireoide e outros devem ser solicitados caso exista alguma disfunção ou suspeita.
1. DOSAGEM DE HORMÔNIOS DA TIREOIDE (T3, T4 E TSH)
A dosagem de hormônios da tireoide através de exame de sangue permite que o médico avalie o funcionamento da glândula, sendo possível verificar se a pessoa possui alterações sugestivas de hipo ou hipertireoidismo.
2. DOSAGEM DE ANTICORPOS
O exame de sangue também pode ser feito para dosar anticorpos contra a tireoide, que podem ser produzidos pelo organismo em algumas doenças autoimunes, como tireoidite de Hashimoto ou doença de Graves, por exemplo. Os principais são:
- Anticorpo anti-peroxidase (anti-TPO): presente na grande maioria dos casos de tireoidite de Hashimoto, doença que provoca a lesão das células e perda gradual da função da tireoide;
- Anticorpo anti-tireoglobulina (anti-Tg): está presente em muitos casos de tireoidite de Hashimoto, entretanto, também é encontrado em pessoas sem qualquer alteração da tireoide, por isso, nem sempre a sua detecção indica que se desenvolverá a doença;
- Anticorpo anti-receptor de TSH (anti-TRAB): pode estar presente nos casos de hipertireoidismo, principalmente causados pela doença de Graves.
3. ULTRASSONOGRAFIA DA TIREOIDE
A ultrassonografia da tireoide é feita para avaliar o tamanho da glândula e a presença de alterações como cistos, tumores, bócio ou nódulos. Embora este exame não possa dizer se uma lesão é cancerosa, é muito útil para detectar suas características e para guiar a punção de nódulos ou cistos para auxiliar no diagnóstico.
4. CINTILOGRAFIA DA TIREOIDE
A cintilografia da tireoide é um exame que utiliza uma pequena quantidade de iodo radioativo e uma câmara especial para obter uma imagem da tireoide, e identificar qual o nível de atividade de um nódulo.
Ela é indicada principalmente para investigar nódulos suspeitos de câncer ou sempre que se suspeita de hipertireoidismo provocado por um nódulo secretor de hormônios, também chamado de nódulo quente ou hiperfuncionante.
5. BIÓPSIA DA TIREOIDE
A biópsia ou punção são feitas para identificar se o nódulo ou cisto na tireoide é benigno ou maligno. Durante o exame, o médico introduz uma agulha fina em direção ao nódulo e retira uma pequena quantidade do tecido ou líquido que forma este nódulo, para que esta amostra seja avaliada em laboratório.
6. AUTOEXAME DA TIREOIDE
O autoexame da tireoide pode ser feito para identificar a presença de cistos ou nódulos na glândula, sendo importante para ajudar a detectar qualquer alteração de forma precoce e prevenir complicações de doenças e deve ser feito, principalmente, por mulheres com mais de 35 anos ou com histórico familiar de problemas na tireoide.
Para realizá-lo, deve-se seguir os seguintes passos:
- Segurar um espelho e identificar o local onde se localiza a tireoide, que fica logo abaixo do pomo-de-adão, conhecido como “gogó”;
- Inclinar um pouco o pescoço para trás, para expor melhor a região;
- Beber um gole de água;
- Observar a movimentação da tireoide e identificar se há qualquer saliência ou assimetria.
Caso seja notada qualquer alteração da tireoide, é importante procurar o atendimento do endocrinologista ou clínico geral para que seja feita a investigação com exames que podem confirmar ou não uma alteração na tireoide.
DOENÇAS MAIS COMUNS NA TIREOIDE
Os nódulos na tireoide são bastante comuns. A prevalência de nódulo tireoidiano varia com o método de detecção utilizado (palpação ou US), a área geográfica e a população estudada.
Quando detectados pela palpação, nódulos acima de 1 a 1,5 cm, em estudos epidemiológicos populacionais, por exemplo Framingham nos Estados Unidos, estão presentes em cerca de 6,4% em mulheres e 1,5% em homens.
Por outro lado, a prevalência de nódulos tireoidianos detectados pela ultrassonografia é muito maior, cerca de 19 a 67%. No mundo, o mais importante fator de risco para o desenvolvimento para o nódulo de tireoide é a deficiência de Iodo.
Em muitos casos nódulos tireoideanos benignos podem ser um problema. Embora não sejam cânceres, e na sua maioria não interfiram na produção hormonal tireoideana, nódulos benignos grandes podem causar sintomas.
Alterações na deglutição e mesmo na respiração, devido à compressão exercida por estes nódulos no esôfago, que é o tubo que conduz o alimento da boca ao estômago, e na traqueia, que conduz o ar inspirado aos pulmões, são queixas frequentes de pacientes portadores desta condição.
De mesmo modo, nódulos aumentados podem causar um efeito estético indesejado no pescoço, evidenciando abaulamento local, simétrico ou assimétrico.
Para estes casos, em que nódulos benignos causam sintomas, a radioablação pode ser realizada visando à diminuição volumétrica destes nódulos, sem interferir na função da tireoide. Isso é feito sem cirurgia e seus potenciais riscos, sob controle ultrassonográfico e com sedação leve apenas.
TRATAMENTO
Tradicionalmente há duas linhas de tratamento para doenças da tireoide. Em pacientes com alterações hormonais, seja hipertireoidismo ou hipotireoidismo, o tratamento medicamentoso é necessário.
Quando há nódulos, que podem ou não afetar a função tireoideana, sejam malignos ou benignos, é imprescindível investigarmos qual sua natureza. Para tanto, as punções aspirativas por agulha fina (PAAF) ou por agulha mais calibrosa (core biopsy), ambas guiadas por ultrassonografia e muito pouco invasivas, servem como elementos diagnósticos importantes.
Uma vez diagnosticada malignidade em um dado nódulo, independentemente de suas dimensões, o tratamento cirúrgico será o de eleição. Em caso de nódulos benignos, não há necessidade de intervenção cirúrgica caso não existam sintomas.
Na presença dos sintomas citados acima, de dificuldades de deglutição, respiração, dor, ou mesmo por questões estéticas, abre-se a discussão acerca do tratamento. A cirurgia, a despeito da altíssima qualidade técnica dos cirurgiões de cabeça e pescoço, apresenta riscos inerentes ao ato cirúrgico que frequentemente são levados em conta na hora da decisão terapêutica.
Da mesma forma é importante salientar que, na grande maioria das vezes, a função de produção hormonal da tireoide não é afetada na presença de nódulos benignos, ainda que volumosos.
Assim, submeter um paciente com nódulos benignos, com função hormonal preservada, ao ato cirúrgico, impõe ao mesmo os riscos inerentes à cirurgia, efeito estético da cicatriz cirúrgica no nível do pescoço, além da necessidade de reposição de hormônios tireoideanos após a cirurgia, frequentemente.
É neste cenário que a ablação de nódulos por radiofrequência se apresenta como alternativa pouco invasiva, precisa, e que permite a preservação do parênquima tireoideano e da produção hormonal. Evita-se assim a temida cicatriz cervical e o uso de medicamentos para repor a função tireoideana para o resto da vida.
Como conclusão, aprendemos que a tireoide é importante e precisamos ter atenção. Mas, caso tenhamos que fazer algum procedimento, a tecnologia atual nos presenteia com ótimas soluções!
Conheça a MA Hospitalar!
Converse com a MA Hospitalar ou conheça nossa loja e saiba mais sobre nossos equipamentos e insumos hospitalares. Estamos prontos para te ajudar!
As causas, os sintomas e os tratamentos da encefalopatia isquêmica são questões que precisam ser amplamente divulgadas devido ao alto potencial de mortalidade e morbidade dessa condição.
A encefalopatia hipóxico-isquêmica (EHI) é uma lesão cerebral causada pela falta de oxigênio e fluxo sanguíneo ao cérebro, especialmente em recém-nascidos durante o parto. Isso pode levar a danos neurológicos sérios e permanentes.
Os sintomas variam, mas incluem convulsões, dificuldades de alimentação e atrasos no desenvolvimento. O tratamento imediato é crucial para minimizar danos e melhorar prognósticos.
A encefalopatia hipóxico isquêmica neonatal continua sendo bastante significativa na questão de mortalidade e morbidade em todo o mundo.
Segundo o Ministério da Saúde, a Encefalopatia Crônica da Infância afeta cerca de duas crianças a cada mil nascidos vivos em todo o mundo — sendo a causa mais comum de deficiência física grave na infância, alterando a comunicação receptiva, expressiva e a habilidade de interação.
Esta alteração, mais conhecida como neuropatologia, ocorre por uma drástica redução da oxigenação de sangue, com um aumento de dióxido de carbono, que se transforma em asfixia, que muitas vezes causam falta de perfusão nos tecidos causando isquemia.
A isquemia cardíaca, ou angina, é uma doença arterial coronariana bastante comum no Brasil. É causada muitas vezes pelo fluxo de sangue, que deveria seguir até o coração, mas está reduzido.
Consequentemente, com esta diminuição de fluxo, o oxigênio também acaba não chegando aos órgãos, que necessitam uma certa quantidade suficiente para seu funcionamento.

Como a encefalopatia hipóxico isquêmica (EHI) acontece?
Na EHI, o feto primeiramente desvia sangue para o cérebro, coração e adrenais (glândulas que secretam hormônios na corrente sanguínea). Esta cascata diminui o oxigênio transportado para os rins, pulmões, intestinos e músculos.
Com o passar do tempo a hipóxia se torna um vilão na metabolização anaeróbica — que é uma forma alternativa de metabolismo onde os níveis de oxigênio são baixos e menos energia é produzida durante a respiração.
Este fato também traz complicações na frequência cardíaca (FC) e pressão arterial (PA) entre outros parâmetros hemodinâmicos. A resolutiva deste tipo de fatores gera a necrose celular, ou seja, a morte celular ou tecidual do organismo ou até mesmo a morte do recém-nascido.
Diagnóstico
O diagnóstico normalmente ocorre intrauterinamente, em consultas de pré-natal, pois, é monitorado com frequência e avaliado através de exames de imagem, para detecção de possíveis deformidades ou problemas que o feto possa indicar.
No caso de encefalopatia hipóxica, o feto apresenta sinais de sofrimento, caracterizado muitas vezes pela desaceleração da FC (frequência cardíaca), bradicardia sustentada, que é quando os batimentos do feto se colocam abaixo de 100 batimentos por minuto — habitualmente este parâmetro deve manter-se entre 110-160bpm.
Após o nascimento, o recém-nascido com EHI apresenta-se deprimido e com APGAR baixo. O APGAR é um teste realizado em bebês após o nascimento — que avalia o estado geral e de vitalidade, ajudando a identificar se é ou não necessária a intervenção ou cuidado médico imediato.
O índice ou teste de APGAR é realizado através de 5 grupos.
1 — Atividade (tônus muscular)
0 = Músculos flácidos;
1 = Dobra os dedos e movimenta os braços ou pernas;
2 = Movimenta-se ativamente.
2 — Batimento cardíaco
0 = Sem batimento cardíaco;
1 = Inferior a 100 batimentos por minuto;
2 = Superior a 100 batimentos por minuto.
3 — Reflexos
0 = Não responde a estímulos;
1 = Faz caretas quando estimulado;
2 = Chora vigorosamente, tosse ou espirra.
4 — Cor
0 = O corpo tem coloração pálida ou azul-acinzentada;
1 = Coloração rosada no corpo, mas azulada nos pés ou mãos;
2= Coloração rosada em todo o corpo.
5 — Respiração
0 = Não respira;
1 = Choro fraco com respiração irregular;
2 = Choro forte com respiração regular.
Após o nascimento, é feito pela equipe médica/pediátrica a interpretação do valor de APGAR, cujo, o ideal é de 10 pontos. Este valor surge, após a soma de cada item, no primeiro minuto de vida do bebê e após o 5° e o 10° minuto de vida, este teste é refeito para certificação de que de fato está bem e poderá ser liberado ou não.
Caso o teste permaneça em pontuação menor que 6 dentro dos 5 minutos de vida do bebê, a equipe clínica encaminha o recém-nascido até a UTI, onde vai ser acompanhado e precisará monitorar os seguintes parâmetros:
• Frequência cardíaca
• Pressão arterial
• Glicemia capilar
• Oximetria
• Diurese (urina)
Para monitoramento destes bebês, as unidades de terapia intensiva, contam com alguns equipamentos como: oxímetros, monitores — em casos graves ventiladores mecânicos, incubadoras entre outros equipamentos.
A espectroscopia de infravermelho próximo cerebral, mais conhecido como NIRS, é um tipo de monitorização, que pode fornecer informações importantes e continuas a equipe clínica. Estes métodos indica as principais alterações hemodinâmicas do bebê, facilitando a ação de forma mais prematura.
O INVOS é um equipamento de grande destaque neste tipo de monitorização, pois fornece informações de forma segura e fidedigna baseada na perfusão cerebral/somática em tempo real, favorecendo a detecção de isquemias e até mesmo monitorando de forma regional a oferta e demanda de oxigênio nos tecidos.
Em relação à condução do tratamento dessa criança, é fundamental o acompanhamento, de preferência multidisciplinar, com neurologia e fisioterapia.
Sabemos que, para o estímulo da neuroplasticidade, estes pacientes precisam ser acompanhados de perto. Todo bebê com asfixia perinatal, especialmente os graves, precisam de um acompanhamento mais constante ainda.
Dificuldades vivenciadas pela família
O prognóstico é algo extremamente importante e delicado, pois, especialmente para a equipe clínica, que se deparam com a situação de ter que comunicar aos pais, também temos toda uma questão familiar, que muitas vezes participaram de uma gestação tranquila e de repente são informados sobre um problema grave como a asfixia.
Estes fatores, em inúmeras vezes, podem levar o recém-nascido ao óbito ou mesmo que o recém-nascido sobreviva, tenha grande chance de ficar com sequelas neurológicas importantes, como dificuldade de fala, atividades diárias comuns, movimentos entre outros estímulos.
Segundo estudos, no processo de amamentação o maior desafio não vem somente do recém-nascido, mas, também impossibilita e dificulta uma questão mais emocional da mãe, pois, a mesma, vivencia e/ou acompanha a inabilidade do neonato, visto que, o mesmo precisa de condições satisfatória para executar adequadamente a sucção, mas, nem todos esses bebês apresentam estas condições.
Estes problemas, são mais acometidos pelas formas anatômicas, estruturais e também alteração neurológica presente no recém-nascido.
Portanto, a escolha dos métodos de tratamento e a equipe profissional, se torna de grande importância, pois, além dar ao bebê uma qualidade de vida melhor dentro de suas possibilidades, a equipe também é responsável por detectar dificuldades e promover apoio para família.

Saiba mais sobre as soluções da MA Hospitalar
Entre em contato pelo nosso site ou nossa loja e fique por dentro dos nossos equipamentos e insumos!
Referências bibliográficas
- Balci C, Haftaci E, Kunt A. Use of cerebral oxygen saturation and hemoglobin concentration to predict acute kidney injury after cardiac surgery; J In Med Res. Mar, 2018;46(3):1130- 1137
- Chan M, Chung T, Glassford N, Bellomo R; Near-Infrared Spectroscopy in Adult Cardiac Surgery Patients: A Systematic Review and MetaAnalysis. J Cardiothorac Vas Anes. Aug, 2017;31:1155-1165
- Kobayashi K, Kitamura T, Miyaji K, et al. Factors associated with a low initial cerebral oxygen saturation value in patients undergoing cardiac surgery. he Official J The Jap Soc For Art Org. Jun, 2017;20(2):110-116
A causa exata do esôfago de Barrett ainda é desconhecida, mas é amplamente considerado uma complicação derivada da doença do refluxo gastroesofágico (DRGE).
Em 1950 o Dr. Norman Barrett, cirurgião torácico de Londres, publicou um artigo chamado de Úlcera péptica crônica do esôfago e esofagite, na qual descreveu úlceras esofágicas cercadas por mucosa colunar encontradas em autópsias.
O esôfago de Barrett é a substituição do epitélio escamoso normal do esôfago distal por metaplasia intestinal (MI).
Causa
O esôfago não possui o mesmo revestimento da mucosa do estômago para resistir à ação do ácido, com isso ocorre uma inflamação quando o ácido reflui do estômago, chamado de esofagite.
A persistência desse refluxo por um longo período de tempo causa uma transformação das células que revestem o esôfago.
O epitélio escamoso normal do esôfago se modifica para o epitélio colunar (revestimento do estômago e intestino) chamado de metaplasia intestinal, condição pré-cancerosa em que as células do estômago estão em processo de diferenciação ficando parecidas com as do estômago, dessa forma resistem melhor ao ácido. Esse esôfago modificado é denominado esôfago de Barrett.
Esta condição muitas vezes é assintomática, porém, em alguns casos, podem aparecer sinais como:
- Azia
- Sabor amargo ou metálico na boca
- Regurgitação
- Arrotos constantes
- Sensação de queimação
- Tosse frequente
- Rouquidão
- Dor no peito
O Esôfago de Barrett afeta mais homens do que mulheres, numa proporção de 3 para 1, é incomum em negros e asiáticos e em alguns estudos, a obesidade e o tabagismo são fatores de risco. Hérnia de hiato também é um grande fator de risco para a doença.
Diagnóstico
O diagnóstico deve ser feito por um gastroeinterologista através de uma endoscopia digestiva alta e biópsia. Esses exames podem ser repetidos ao longo do tratamento, para verificar como está progredindo.
O esôfago de Barrett não tratado pode evoluir para estágios mais sérios, como adenocarcinoma de esôfago, um tipo de câncer. É o maior fator de risco presente em metade dos casos de câncer de esôfago.
Esta doença é dividida em três estágios:
▪ Metaplasia Intestinal Sem Displasia: Presença de esôfago de Barrett, porém nenhuma alteração cancerosa e visível nas células da parede d esôfago.
▪ Displasia de Baixo Grau: As células mostram sinais precoces de alterações pré-cancerosas que podem levar ao câncer de esôfago.
▪ Displasia de Alto Grau: As células do esôfago apresentam um alto grau de alterações pré-cancerosas. Condição anterior ao câncer de esôfago.
Confira abaixo imagens que mostram os estágios do esôfago de Barrett:
1. Esôfago sadio;
2. Esôfago danificado por exposição prolongada ao ácido;
3. Tecido do esôfago de Barrett;
4. Esôfago de Barrett com displasia;
5. Adenocarcinoma de esôfago.
O exame que confirma ou descarta o diagnóstico de câncer de esôfago é a biopsia, feita por endoscopia guiada por ultrassom ou tomografia, quando é retirada uma amostra de tecido que é enviada para análise pelo patologista.
Além disso, o médico pode pedir tomografia de tórax e abdome, broncoscopia. PET-CT e ecoendoscopia para avaliar o estágio do tumor, sua disseminação e sua profundidade.
Tratamento
Após o diagnóstico, um médico irá discutir as opções de tratamento para esôfago de Barrett, baseado na saúde geral da pessoa, se a displasia está presente e, caso afirmativo, a gravidade da displasia. Opções de tratamento incluem medicamentos, terapias ablativas endoscópicas, ressecção endoscópica da mucosa e cirurgia.
Conheça os equipamentos e insumos da MA Hospitalar
Saiba mais sobre as soluções da MA Hospitalar. Estamos comprometidos em trazer saúde e bem-estar para você e para a sua instituição. Fale conosco ou conheça a nossa loja!
REFERÊNCIAS
- O que é o esôfago de Barret
- Esôfago de Barret, Tua saúde
- Esôfago de Barret, Minha vida
- Câncer de esôfago
- BARRETT NR (October 1950). “Chronic peptic ulcer of the oesophagus and ‘oesophagitis'”. Br J Surg. 38 (150): 175–82. doi:10.1002/bjs.18003815005. PMID 14791960.
- Shaheen NJ, Richter JE. Barrett’s oesophagus. Lancet. 2009;373(9666):850-61.
Notas
1. Based on comparison of average total operation time reported in B550 and SURF randomized clinical trials. Data on file, 2016.
2. Phoa N, van Vilsteren F, Weusten B, Bisschops R, Schoon E, Ragunath K, et al. Radiofrequency Ablation vs. Endoscopic Surveillance for Patients with Barrett’s Esophagus and Low-Grade Dysplasia–A Randomized Clinical Trial. JAMA. 2014;311(12):1209-17. doi:10.1001/jama.2014.2511.
Ela atinge de forma praticamente igual a homens e mulheres, e suas causas podem ser diversas e muitas vezes desconhecidas.
A leucemia é um câncer que tem início nas células-tronco da medula óssea. Tem como principal característica o acúmulo de células doentes que substituem as células sanguíneas normais na medula óssea.
A medula óssea é o local de fabricação das células sanguíneas e ocupa a cavidade dos ossos, sendo popularmente conhecida por tutano. Nela são encontradas as células que dão origem aos glóbulos brancos (leucócitos), aos glóbulos vermelhos (hemácias ou eritrócitos) e às plaquetas.
Um levantamento do Instituto Nacional do Câncer (INCA) mostra que mais de 10 mil pessoas tiveram a doença em 2020.
São mais de 500 mil casos novos a cada ano no mundo, segundo a Organização Mundial da Saúde (OMS).
TIPOS DE LEUCEMIA
Existem mais de 12 tipos desta enfermidade, sendo os quatro primários: leucemia mieloide aguda (LMA), leucemia mieloide crônica (LMC), leucemia linfocítica aguda (LLA) e leucemia linfocítica crônica (CLL).
A leucemia pode ser classificada como “aguda” ou “crônica” de acordo com a velocidade de crescimento das células doentes assim como de sua funcionalidade.
O tipo agudo progride rapidamente e produz células que não estão maduras e não conseguem realizar as funções normais.
Já a leucemia crônica normalmente progride lentamente e os pacientes têm um número maior de células maduras. Em geral, essas poucas células maduras conseguem realizar algumas das funções normais.
SINTOMAS
Muitos pacientes com tipos de leucemia de crescimento lento não têm sintomas. Um sinal é quando se sente dores locais nas articulações ou ossos.
Os tipos de leucemia de crescimento rápido podem causar também sintomas que incluem fadiga, perda de peso, febre, suores noturnos, cansaço, perda de peso, infecções frequentes e sangramento fácil ou hematomas.
Os sintomas de leucemia em fase terminal podem incluir fadiga extrema, infecções frequentes, sangramento intenso, dor óssea intensa, perda de peso não intencional, febre persistente e dificuldade para respirar. Um diagnóstico médico é essencial e quanto mais cedo, maiores as chances de combatê-la.
O aparecimento de gânglios indolores, principalmente nas regiões do pescoço, axilas, clavícula e na fossa do cotovelo também podem ser observados comumente nas leucemias, principalmente da leucemia linfocítica aguda (LLA) e da leucemia linfocítica crônica (LLC), onde mais de 50% dos pacientes apresentam esta alteração. Na leucemia mieloide aguda (LMA) o aumento dos linfonodos é pouco comum.
AUMENTO DO BAÇO
O baço é uma espécie de linfonodo gigante, cuja principal função é destruir as células sanguíneas velhas, defeituosas e que apresentam mal funcionamento. Seu aumento provoca fortes dores abdominais.
TRATAMENTO
O tratamento, na maior parte das vezes, é feito com quimioterápicos, mas varia muito conforme o risco, a gravidade e as características de cada paciente.
Para leucemias de crescimento lento, a busca da cura pode incluir o monitoramento. Para leucemias agressivas, o tratamento inclui quimioterapia, que, às vezes, é seguida por radioterapia e transplante de medula óssea e células-tronco (TMO).
Fatores como idade e outras doenças associadas também influenciam a resposta que o paciente pode dar na primeira fase do tratamento, quando normalmente também se checa a disponibilidade de doadores de medula óssea.
O paciente é monitorado por 5 anos até que possa ter alta.
LEUCEMIA NO CINEMA

A leucemia já foi tema de cinema muitas vezes. Listamos 6 filmes que abordam o assunto através da sétima arte e vão tocar você.
- UMA PROVA DE AMOR
Ana é uma adolescente que já nasceu com um propósito: salvar a vida de sua irmã Kate que tem leucemia. Para isso ela foi concebida com a ajuda da medicina para que pudesse ser uma doadora compatível.
- LADO A LADO
Duas mulheres completamente diferentes que não se suportam, afinal, uma é a ex-mulher e a outra a atual de Luke e, por isso, acabam dividindo de alguma maneira a atenção de uma adolescente e uma criança. Elas acabam precisando aprender a conviver quando uma grave doença surge e duas crianças estão no meio da situação.
- PRONTA PARA AMAR
O filme conta a história de uma jovem bem sucedida que já não acredita mais no amor até que sua vida é colocada de cabeça para baixo, quando seu médico, o doutor Julien, descobre que ela está com uma grave doença.
- A CULPA É DAS ESTRELAS
Inspirado no romance best-seller do premiado John Green, o filme explora uma romântica e divertida aventura de dois adolescentes em fase terminal.
- MINHA VIDA
Bob é o proprietário de uma empresa de relações públicas, cujo casamento sólido e feliz com Gail Jones superou suas expectativas. Logo ele recebe duas notícias: primeiro, Jones descobre que será pai pela primeira vez. Logo em seguida é informado que sofre de uma doença terminal. Sabendo que poderá estar morto antes de seu filho nascer, ele resolve então fazer um vídeo apresentando-se a ele e discorrendo sobre os momentos mais alegres e mais penosos de sua vida.
- LAÇOS DE TERNURA
Aurora e Emma vivem os altos e baixos da relação mãe e filha. Enquanto Aurora, mãe protetora e viúva há alguns anos, não aprova o casamento de sua filha, Emma vive o drama de saber que seu marido a trai. Entre desentendimentos e alegrias, Emma descobre que tem câncer.
SEJA UM DOADOR DE MEDULA ÓSSEA
Doar medula óssea é um procedimento simples que pode salvar muitas vidas ao redor do planeta. Na MA Hospitalar, estamos ao lado dessa causa. Conheça mais sobre a doação de medula óssea.
Para saber sobre nossas soluções, entre em nossa loja ou fale conosco!
