Tradicionalmente, os anestesiologistas administram os gases e os agentes anestésicos (AA) ajustando manualmente as concentrações dos vaporizadores e os fluxos de gases frescos (FGF).
Você sabia que é é tecnicamente possível realizar a anestesia de baixo fluxo de forma automática, através do controle expirado (ET) no final da expiração?
Com a evolução da pandemia, onde todos os recursos estão sendo direcionados de maneira integral na promoção de saúde e tratamento dos pacientes contaminados pela Covid-19 — todas as alternativas e tecnologias que possam vir a contribuir na amenização das consequências serão bem-vindas.
E, cada vez mais, as inovações tecnológicas estão sendo implantadas com intuito de oferecer a melhor qualidade no atendimento de todos.
Para a área de anestesiologia, podemos contar com ferramentas que auxiliam no monitoramento seguro da técnica de anestesia de baixo fluxo para possibilitar o uso racional dos medicamentos anestésicos, conforme recomenda a Sociedade Brasileira de Anestesiologia (SBA), principalmente neste cenário atual.
Além disso, o custo e a poluição ambiental são duas das principais preocupações com a anestesia geral, que podem estar sendo solucionadas também com esse recurso.
Primeiramente, para trabalhar com segurança, você deve se lembrar dos princípios básicos farmacológicos e fisiológicos subjacentes. É importante entender como as concentrações de gás se comportam em um sistema circular e como elas dependem de diferentes fluxos de gases frescos (FGF).
Na prática, o anestesista precisa conhecer os possíveis riscos e benefícios de uma determinada técnica. E, em especial, na anestesia com baixo fluxo e mínimo, o médico deve compreender a importância do monitoramento da ventilação e da medição das concentrações de gases e agentes anestésicos.
A anestesia geral inalatória é aplicada e monitorada por um anestesista.
Comumente, a técnica de baixo fluxo é realizada manualmente, ou seja, o médico define o alvo da concentração de oxigênio, necessitando alterar quando preciso a fração de gás inspirado (FiO²), o fluxo de gás fresco e as concentrações do vaporizador para garantir a aplicação ideal da anestesia, minimizando o desperdício de anestésico e possibilitando maior segurança para o paciente.
No entanto, existe uma alternativa de realizar essa técnica de maneira mais eficaz e segura que é através da automação.
O anestesista irá definir o alvo da fração expirada de oxigênio (EtO²) e os valores da fração expirada de agente anestésico (EtAA) e a máquina ajustará automaticamente a administração do agente e o FGF total para atingir e/ou manter os valores estabelecidos, otimizando o fluxo de trabalho do anestesista.
ANESTESIA DE BAIXO FLUXO
A anestesia com baixo fluxo é uma técnica que usa um sistema de reinalação para retornar pelo menos 50% do valor exalado de gases para o pulmão do paciente após a eliminação de dióxido de carbono (CO²).
Sua popularidade e uso estão aumentando em todo o mundo devido à crescente importância do controle de custos, maior consciência ambiental e a disponibilidade de equipamentos avançados de anestesia.
Devido ao seu baixo custo, a anestesia de baixo fluxo está se tornando cada vez mais difundida. Body et al. relataram que a taxa de fluxo de gás fresco usada em seu hospital foi de 1,8 L/min.
Tohmo et al. relataram que a frequência de uso do sistema de reinalação para a prática de anestesia na Finlândia aumentou de 62% em 1995 para 83% em 2002, enquanto a taxa de fluxo de gás fresco diminuiu de 3L/min para 1-2L/min no mesmo tempo.
Kennedy et al. avaliaram as mudanças no fluxo de gás fresco em um hospital de treinamento na Nova Zelândia em 2001 e 2006, e relataram que a taxa média de fluxo de gás fresco foi de 1,5 L / min em 2001 e diminuiu para 1,27 L / min em 2006, representando uma redução de 35% no fluxo de gás fresco em 4 anos.
REQUISITOS BÁSICOS PARA ANESTESIA DE BAIXO FLUXO
A anestesia de baixo fluxo pode ser definida como uma técnica em que o FGF é adaptado para atender a necessidade do oxigênio do paciente (cerca de 200mL/min) e de anestésicos voláteis. Além disso, existe a cal sodada (absorvedor de CO²) que faz a remoção do CO² do circuito respiratório.
Para a realização da técnica de anestesia de baixo fluxo, existem alguns requisitos técnicos que são importantes para sua execução segura. Dentre eles, podemos citar:
- Sistema de respiração circular com absorção de CO²;
- Medidores de fluxo precisos para ajuste de fluxos de gás fresco abaixo de 1,0L/min;
- Vaporizadores precisos, capazes de fornecer de maneira confiável concentrações de agentes anestésicos voláteis com FGF abaixo de 1,0L/min;
- Deve haver um sistema respiratório estanque aos gases. O teste de vazamento recomendado deve ser abaixo de 150mL/min no teste de pressão de 30cmH²O. Normalmente, o fole ascendente que não sobe até o topo da câmara do fole pode indicar vazamento no sistema respiratório. Outra indicação de vazamento no circuito pode ser que o ALARME BAIXO da pressão de pico das vias aéreas se tornaria ativo. Além disso, se os loops de espirometria exibidos na tela do monitor não fecharem corretamente, isso também pode indicar um vazamento;
- O sistema respiratório deve ter volume interno mínimo e um número mínimo de componentes e conexões.
- O monitoramento contínuo de gás deve ser empregado. As concentrações de gás inspiratório e expiratório devem ser medidas a cada ciclo respiratório.
Além dos requisitos acima, o monitoramento da ventilação deve sempre ser empregado. A medição do CO² expirado fornecerá essa informação e ajudará a controlar a ventilação alveolar do paciente.
Para controlar os volumes do sistema respiratório e a mecânica pulmonar do paciente, informações adicionais podem ser obtidas monitorando as pressões das vias aéreas, os volumes respiratórios e os loops de espirometria.
SISTEMA CIRCULAR E SEUS COMPONENTES
O uso de agentes anestésicos inalatórios em circuito fechado ou semifechado leva à reinalação dos agentes anestésicos voláteis. Isso leva à diferença na concentração fornecida e inspirada de agentes anestésicos voláteis, dependendo do fluxo de gás fresco (FGF).
E, dependendo do FGF entregue, o sistema circular pode funcionar em diferentes formas.
- A anestesia de alto fluxo usa um FGF, que está próximo do volume-minuto do paciente (em média 3 a 6L/min em um adulto normal);
- A anestesia com baixo fluxo usa um FGF de menos da metade do volume-minuto do paciente, o que é mais frequentemente inferior a 3,0L/min em média em um adulto normal;
- Na anestesia com fluxo mínimo, o FGF é reduzido para 0,5L/min.
- Na anestesia de sistema fechado, o FGF é adaptado para igualar a necessidade do oxigênio do paciente e agentes anestésicos.
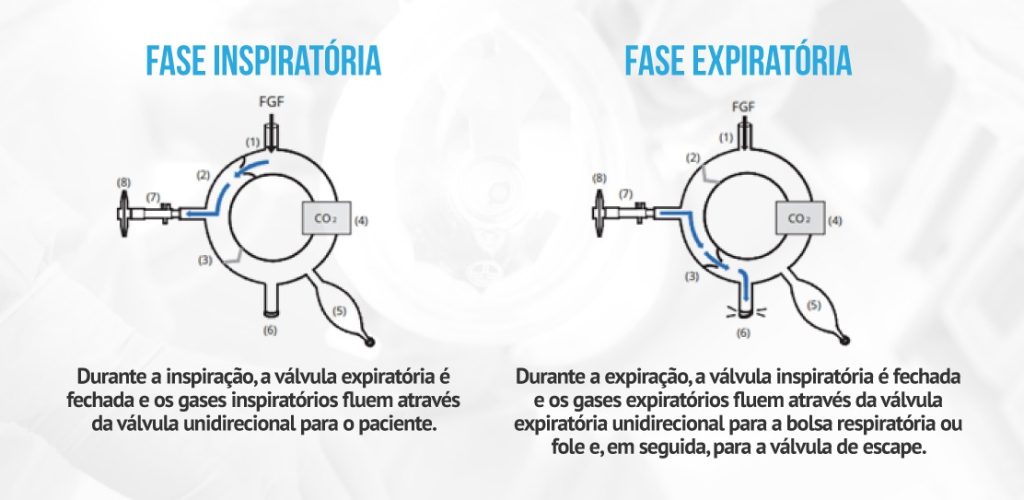
A lista de componentes de um sistema circular seguirá:
- Entrada de FGF
- Ramo inspiratório com válvula unidirecional
- Ramo expiratório com válvula unidirecional
- Absorvente para remoção de CO²
- O volume do reservatório para ventilação com pressão positiva, tanto com bolsa manual quanto com fole do ventilador, pode ser conectado aqui.
- Válvula de exaustão para eliminação de gases residuais
- Peça em Y do paciente, sensor de fluxo de espirometria e mostrador de gás
- Filtro bacteriano pode ser adicionado aqui
QUAIS AS VANTAGENS DO SISTEMA CIRCULAR?
A vantagem dos sistemas circulares é que eles permitem o uso de FGF baixo ou mínimo. São, no entanto, sistemas estruturalmente complexos e quando baixo FGF é usado, as concentrações de gás inspirado não se relacionam intimamente com as concentrações de FGF administradas pela máquina anestésica.
Monitores de gás sofisticados, integrados em máquinas anestésicas modernas, são, portanto, essenciais. Em resumo, podemos destacar as seguintes vantagens:
- Baixos custos;
- Diminui a contaminação;
- Maior precisão na medida dos volumes;
- Monitoração direta do consumo de O²;
- Melhor umidificação.
QUANTO TEMPO POSSO USAR A CAL SODADA (ABSORVEDOR DE CO²) SEM SUBSTITUIÇÃO?
A cal sodada faz parte da prática clínica diária do anestesiologista. É ela que permite o uso de baixo fluxo de gases frescos a fim de reduzir o consumo de anestésico, manter a temperatura corporal do paciente, conservar a umidade das vias aéreas e evitar poluição na sala de cirurgia.
Devido ao menor consumo de gases e de anestésicos, torna-se um aliado econômico da unidade hospitalar.
Além de manter a umidade do ar inalado, evitando os efeitos deletérios de gases secos, tais como ressecamento, inflamação e perda dos movimentos ciliares, leva à redução do fluxo, causando diminuição da complacência pulmonar.
A absorção do CO² é uma reação química exotérmica. No sistema em circuito fechado, a água e o calor da reação contribuem para a umidificação e o aquecimento da mistura.
A capacidade de absorção de CO² é baseada no volume-minuto do paciente, o volume da cal sodada e a taxa de FGF selecionada. Quanto menor o FGF, mais o gás é reciclado no circuito, maior a remoção de CO² pelo absorvedor. Contudo, o baixo FGF, levará a necessidade de troca da cal sodada mais vezes ao dia.
ENTÃO, QUANDO A CAL SODADA DEVE SER TROCADA?
A troca da cal sodada deve ocorrer quando houver um aumento considerável nos valores medidos da fração inspirada de CO² (FiCO²) e sem alterações significativas nas configurações da ventilação do paciente.
Outro ponto visível que indica a troca da cal sodada é a mudança da coloração para roxa. Quando a cor da cal sodada muda permanentemente isso sinaliza a hora de trocar o absorvedor. Porém, é importante se atentar que depois de algum tempo, essa mudança de cor pode desaparecer.
Portanto, é melhor trocar o absorvedor por conta própria em vez de deixá-lo durante a noite, pois as pessoas no dia seguinte podem não estar cientes das informações sobre a capacidade do absorvedor.
VOCÊ SABIA?
O potencial de superfornecimento ou subfornecimento tanto do agente quanto da concentração final de oxigênio é o grande desafio da atualidade na anestesia, mas a automação pode ajudar você a superá-lo.
A otimização do fornecimento de agente anestésico e de oxigênio pode ajudar você a aumentar a qualidade do atendimento de seus pacientes, incluindo os que precisam de cuidados extras.
AFINAL, O QUE É ANESTESIA DE BAIXO FLUXO AUTOMÁTICA?
A anestesia inalatória controlada pelo alvo da EtO2, também chamada de controle expirado, é um sistema de realização de anestesia disponível nas máquinas mais recentes.
Nessa modalidade a máquina ajusta automaticamente o fluxo de gás fresco total e a concentração do agente anestésico para atingir os níveis desejados definidos pelo anestesista.
Automatizar o processo de monitoramento e ajuste das concentrações de gás encurta a indução anestésica e resulta em concentrações anestésicas arteriais e cerebrais mais estáveis, estabilizando o nível de anestesia.
Também minimiza a quantidade de gás fresco e anestésico desperdiçado, reduzindo os custos de saúde e a carga ambiental.
O consumo de agentes inalatórios não depende apenas do FGF, mas também da solubilidade relativa do gás. Assim, o monitoramento das pressões parciais dos agentes inalados dentro do sistema respiratório é desejável.
O uso de agentes anestésicos inalatórios em circuito fechado ou semifechado leva à reinalação dos agentes anestésicos voláteis. Isso leva à diferença na concentração fornecida e inspirada de agentes anestésicos voláteis, dependendo do FGF.
COMO FUNCIONA?
O circuito respiratório interno da anestesia consiste em um misturador de gás que controla a quantidade de oxigênio e ar ou óxido nitroso fornecido ao paciente, dependendo das configurações.
As válvulas seletoras abrem de acordo com o modo de seleção. Os sensores monitoram continuamente o misturador de gás.
O gás misturado sai do misturador e flui para o vaporizador eletrônico, onde a vaporização do agente ocorre usando um fluxo de desvio convencional e o princípio de vaporização livre. Então, o gás comum com o agente flui através das válvulas de entrada e saída.
No entanto, a entrega real do agente é controlada pelo “vaporizador eletrônico” interno. Este dispositivo regula o fluxo de desvio e controla as válvulas de entrada e saída para atingir a saída desejada no gás fresco.
Vários sensores no caminho do gás monitoram constantemente o fluxo e a pressão para garantir a concentração de vapor desejada no FGF, mesmo em taxas mínimas. O consumo dos vários gases inalados é calculado automaticamente pelo software computadorizado embutido na máquina.
E QUAIS AS VANTAGENS DA AUTOMAÇÃO?
Dentre as vantagens da anestesia de baixo fluxo automática, podemos destacar:
- Com a facilidade da automação, a carga de trabalho é reduzida para o anestesista, possibilitando que ele se preocupe com outros pontos;
- Efetividade na entrega de agentes, otimizando a entrega do FGF;
- Guarda hipóxica inteligente (mínimo 25%) com a manutenção de fluxos baixos;
- Economia de gases e AA, impactando nos custos e poluição ambiental;
Sabemos que o consumo de medicamentos anestésicos está excessivo devido ao problema mundial de saúde que estamos enfrentando desde 2020 por conta da Covid-19.
E, com isso, a técnica de anestesia de baixo fluxo automática é uma alternativa eficaz e segura para racionalizar o uso desses medicamentos, além de contribuir na redução dos custos hospitalares e poluição ambiental, bem como oferecer uma maior segurança no atendimento do paciente.
Entre em contato conosco ou acesse nossa loja para saber mais sobre nossas soluções!
REFERÊNCIAS BIBLIOGRÁFICAS
- ARAI, L. A. C; AZEVEDO, R. B. Contaminação do Aparelho de Anestesia por Agentes Patógenos. Rev Bras Anestesiol. Vol. 61, nº 1, 2011: 50-59.
- BODY, S. C; FANIKOS, J; DePEIRO, D. et al. Individualized feedback of volatilee agent use reduces fresh gas flow rate, but fails to favorably affect agent choice. Anesthesiology 1999;90:1171–5.
- Tohmo H, Antila H. Increase in the use of rebreathing gas flow systems and in the utilization of low fresh gas flows in Finnish anaesthetic practice from 1995 to 2002. Acta Anaesthesiol Scand. 2005 Mar;49(3):328-30.
- Kennedy RR, French RA. Changing patterns in anesthetic fresh gas flow rates over 5 years in a teaching hospital. Anesth Analg. 2008;106:1487–90.
- POTDAR, M. P; KAMAT, L. L; SAVE, M. P. Cost efficiency of target-controlled inhalational anesthesia. Journal of Anaesthesiology Clinical Pharmacology. April-June, 2014. Vol 30.
- HERBERT, L; MAGEE, P. Circle systems and low-flow anaesthesia. BJA Education. Volume 17, Number 9, 2017.
- NICE. End-tidal Control software for use with Aisys closed circuit anaesthesia systems for automated gas control during general anaesthesia. Medtech innovation briefing. 2014.
- KALLI, I. Clinical performance of electronic control for Aisys™, to automatically adjust fresh gas, agent and oxygen. Helsinki University Central Hospital, Helsinki, Finland.

