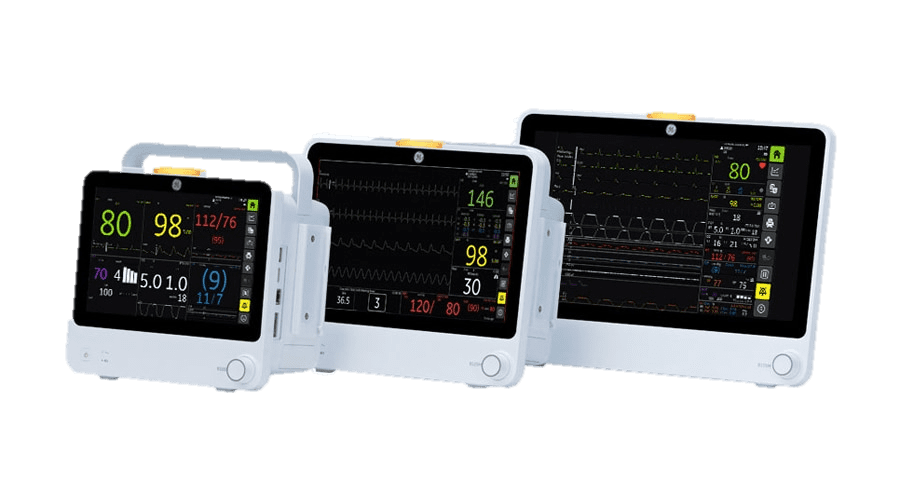
O módulo de transmissão neuromuscular (TNM) da GE Healthcare é utilizado para avaliar o bloqueio neuromuscular no paciente através da administração de bloqueadores neuromusculares durante o procedimento cirúrgico.
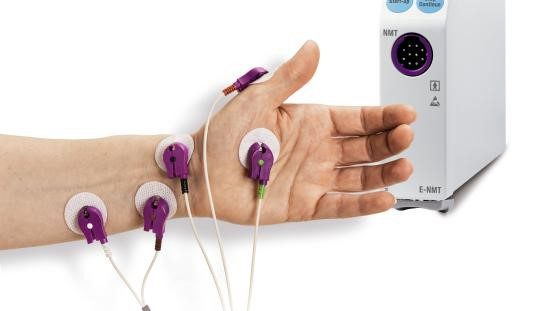
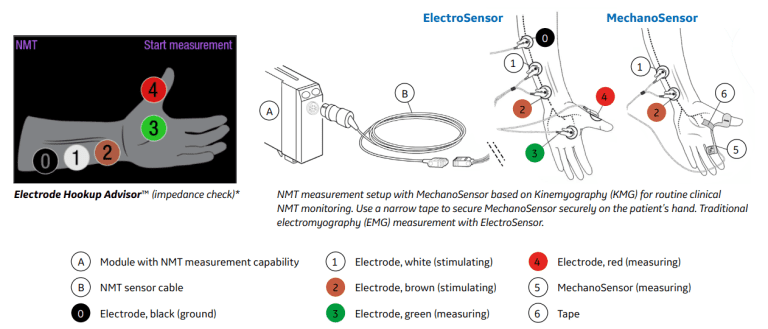
O módulo de TNM proporciona impulsos de estimulação elétrica de um nervo periférico e mede sua resposta neuromuscular a este estímulo. A linha de acessórios TNM GE Healthcare inclui eletrossensores (Figura 1) e mecanossensores (Figura 2) para adultos e para crianças entre 5 e 40 Kg.
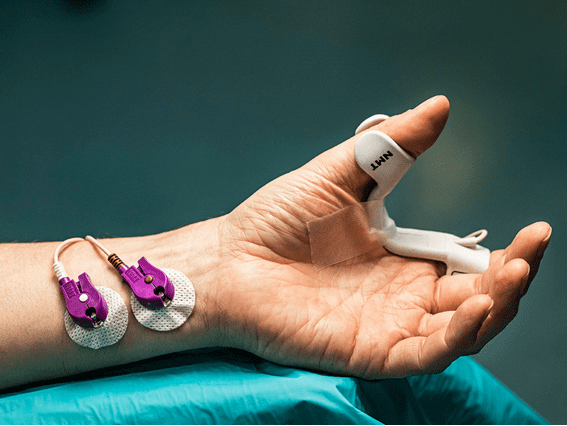
O mecanossensor mede o movimento do polegar utilizando um sensor piezoelétrico, que converte o movimento físico em um sinal elétrico e quantifica a resposta mecânica gerada. Já o eletrossensor mede diretamente a atividade elétrica do músculo com eletrodos, quantificando a resposta à estimulação nervosa. O eletrossensor pode ser utilizado na mão ou no pé do paciente, tanto em pacientes adultos como pediátricos.
Por que utilizar um módulo de transmissão neuromuscular durante o procedimento cirúrgico?
Durante alguns procedimentos cirúrgicos, agentes bloqueadores neuromusculares podem ser utilizados com o objetivo de facilitar a intubação e garantir condições ideais para a cirurgia. No entanto, o uso desses fármacos pode elevar o risco de efeitos adversos pós-operatórios. A paralisia residual é uma grande preocupação, pois aumenta a morbidade e mortalidade pós-operatória, o tempo de internação e ainda aumenta os custos concomitantes a essas complicações.1, 2, 3, 4 e 5
Durante todo o procedimento anestésico, o médico deve avaliar continuamente a função neuromuscular do paciente. Apesar de existirem métodos mais convencionais para avaliar a função neuromuscular em pacientes sob efeito de anestésico, como a capacidade de levantar a cabeça, aperto de mão firme ou ventilação minuto suficiente, há uma grande evidência científica mostrando a superioridade e benefícios do uso da avaliação clínica associada à monitorização neuromuscular quantitativa.
Os monitores de transmissão neuromuscular fornecem medições numéricas de forma automática, indicando a resposta muscular a um estímulo e o nível associado de bloqueio neuromuscular. Tecnologia que até pouco tempo estava distante, mas que está cada vez mais presente e disponível dentro dos ambientes cirúrgicos.
Portanto, de acordo com Duţu et al. (2019), o uso da monitorização neuromuscular como guia na reversão de agentes bloqueadores ajuda a evitar o bloqueio neuromuscular residual, trazendo mais segurança para o paciente.
- Medição automatizada
- Maior adequação das doses de relaxantes neuromusculares
- Recuperação otimizada
- Maior segurança do paciente diminuindo riscos de complicações
- Orientação quanto ao momento da extubação
- Informação integrada no monitor
Como essa medição é realizada?
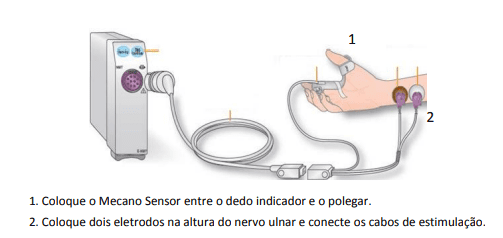
Através de um eletrodo e uma estimulação no nervo ulnar ou nervo plantar medial, uma resposta imediata será gerada no monitor. Dessa forma, é possível avaliar a profundidade do bloqueio neuromuscular.
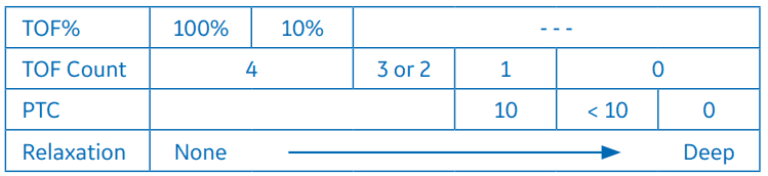
O padrão de monitorização é uma sequência de quatro estímulos, também chamado de Train-of-four (TOF). A estimulação TOF permite a contagem do número de contrações musculares provocadas e o cálculo da proporção da quarta para a primeira resposta de contração.
Quando não são detectadas respostas para a estimulação TOF, a contagem pós-tetânica (CPT) é a única forma de medir o bloqueio neuromuscular. É gerada uma estimulação tetânica (50 Hz) durante cinco segundos e são contadas as respostas pós-tetânicas para estímulo único. Quanto maior for a CPT (o número de respostas detectadas), mais rápido retornarão as respostas normais de TOF.
Na prática:
São necessários dois eletrodos para a estimulação elétrica de um nervo periférico (Figura 3). A resposta resultante pode ser medida com dois eletrodos e um mecanossensor, que mede os movimentos entre o polegar e o indicador, ou com um eletrossensor, que utiliza três eletrodos de registro.
O monitor procura a corrente de estímulo necessária para ativar todas as fibras dos músculos estimulados (registrados). A pesquisa é iniciada com um estímulo de 10 mA e a resposta é medida. A corrente aumenta em incrementos de 5 mA até que o aumento da corrente deixe de aumentar a resposta. Essa corrente máxima é, então, automaticamente aumentada em 15%, resultando em uma corrente supramáxima.
Se não for encontrada a corrente supramáxima ou se a resposta for muito fraca para a pesquisa de uma corrente supramáxima, a corrente será ajustada para 70 mA.
Modos de estimulação
- Train of four, TOF: Recomendado para a maioria dos casos. Também é a definição padrão.
- Estimulação por impulso duplo, DBS: Útil com a utilização do mecanossensor. Permite uma melhor observação visual da diminuição nas respostas.
- Contagem pós-tetânica, PTC: Utilizada para calcular o nível de relaxamento com estimulação tetânica.
- Estímulo único, EstÚni: O modo de estímulo único é prático quando se utilizam relaxantes despolarizantes: nesses casos, a TOF% não fornece informações adicionais sobre o estado do paciente.
Como interpretar os valores de TNM?
No modo de estímulo TOF, são emitidos 4 pulsos de estimulação em intervalos de 0,5 segundos. A resposta é medida após cada estímulo e calcula-se a relação da quarta com a primeira resposta da sequência TOF, o que resulta em TOF% (Figura 4).
Com o eletrossensor, é exibida a T1%. Se a referência for localizada com êxito, uma escala também será incluída. Os marcadores da escala representam os valores de referência 0%, 30%, 60%, 90% e 120% (Figura 5). Quando não há qualquer referência disponível, não é apresentado nenhum valor de T1% e as barras não são representadas em escala. Quando o relaxamento se aprofunda, a TOF% desce até a quarta resposta desaparecer e não existir qualquer TOF% disponível.
O grau de bloqueio neuromuscular é, então, calculado a partir do número de respostas, a contagem, que representa o número de respostas detectadas para os quatro estímulos. Quanto menor for o número de respostas, mais profundo será o relaxamento.

Passo a passo do uso do TNM
Passo 1
Coloque adequadamente o sensor de sua escolha (Figura 6). Pressione início da medição. O monitor iniciará a medição definindo automaticamente a corrente de estímulo e realizando uma medição de referência. Com o paciente não relaxado, TOF% é 100 (Figura 7).
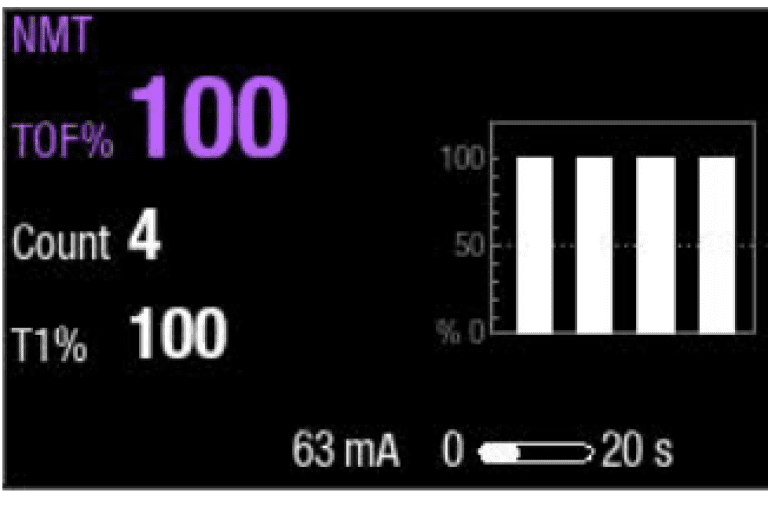
Passo 2
Os relaxantes não despolarizantes causam um desaparecimento das respostas, indicado por um TOF% mais baixo e uma inclinação no gráfico de barras. Os relaxantes despolarizantes resultam em uma queda igual em todas as quatro respostas, sem desaparecimento.
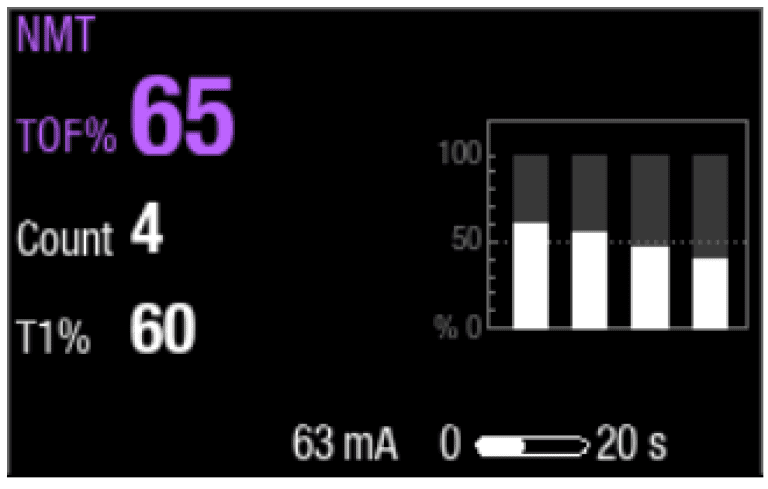
Passo 3
O bloqueio neuromuscular pode ser utilizado para facilitar a intubação endotraqueal. O médico pode usar o tempo em que todas as respostas desaparecem (ou seja, a contagem TOF é 0) como um guia para determinar quando intubar.

Passo 4
Durante a cirurgia e em cuidados intensivos, a contagem TOF (Count) é usada para manter um nível ideal constante de bloqueio neuromuscular. Quando a contagem TOF excede um nível definido pelo usuário, o monitor GE exibirá uma mensagem de “Bloco de recuperação”.

Passo 5
Com base no tipo de agente de reversão que deseja utilizar, você pode cronometrar a administração usando TOF% e contagem de contrações. Para uma extubação segura, o TOF% deve ser superior a 90.7
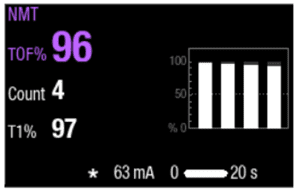
Onde encontrar TNM nos monitores da GE Healthcare?
É possível realizar a monitorização da Transmissão Neuromuscular em todos os monitores da GE Healthcare (B105, B125 e B155 a partir da versão 3 e B450, B650 e B850) através do módulo E-NMT.

Saiba mais
Conheça outras funcionalidades dos monitores da GE Healthcare, como o oxicardiorrespirograma e o monitoramento de gases.
Entre em contato com a MA Hospitalar e adquira o seu!
Referências
- 1. Herbstreit F, Peters J, Eikermann M. Impaired upper airway integrity by residual neuromuscular blockade: increased airway collapsibility and blunted genioglossus muscle activity in response to negative pharyngeal pressure. Anesthesiology 2009;110:1253-60.
- 2. Eikermann M, Groeben H, Husing J, Peters J. Accelerometry of adductor pollicis muscle predicts recovery of respiratory function from neuromuscular blockade. Anesthesiology 2003;98:1333-7.
- 3. Eriksson LI, Sato M, Severinghaus JW. Effect of a vecuronium-induced partial neuromuscular block on hypoxic ventilatory response. Anesthesiology 1993;78:693-9.
- 4. Murphy GS, Szokol JW, Marymont JH, Greenberg SB, Avram MJ, Vender JS. Residual neuromuscular blockade and critical respiratory events in the postanesthesia care unit. Anesth Analg 2008;107:130-7.
- 5. Berg H, Roed J, Viby-Mogensen J, Mortensen CR, Engbaek J, Skovgaard LT, Krintel JJ. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand 1997;41:1095-103.
- 6. Duţu M, Ivaşcu R, Tudorache O, et al. Neuromuscular monitoring: an update. Rom J Anaesth Intensive Care. 2018;25(1):55–60.
- 7. Naguib M, Brull SJ, Kopman AF, et al. Consensus Statement on Perioperative Use of Neuromuscular Monitoring. Anesth Analg 2018; 127:71-80.
Contexto para a hipotermia
O organismo humano possui um sistema termorregulador que mantém a temperatura corporal em torno de 37°C a fim de manter o metabolismo basal eficaz através do equilíbrio na produção de calor (termogênese) e da dissipação de calor (termódise).
A termogênese depende da reserva de calor e do oxigênio necessário para a metabolização das reservas de energia diminuída em pessoas exaustas, hipóxicas ou traumatizadas.
A termódise depende de vestimentas e fatores ambientais.
Termólise
- Irradiação: A pele irradia calor para o meio ambiente e este esfria a pele.
- Condução: Perda de calor por contato. Depende da temperatura das substâncias que entram em contato e sua capacidade condutora. Ex.: mesa cirúrgica.
- Convecção: É uma forma especial de condução que se refere ao movimento do ar. Quanto maior a velocidade do ar, maior a transferência de calor.
- Evaporação: Perda de calor quando um líquido passa ao estado gasoso. Tem dois componentes, pele e respiração. Em cirurgias com exposição visceral pode aumentar de forma considerável a perda de temperatura.
Se tratando de ambiente hospitalar, durante um procedimento anestésico cirúrgico, foi constatado que 20% dos pacientes apresentam hipotermia no período perioperatório, principalmente causada pela ação direta das drogas anestésicas e pelo resfriamento do ambiente cirúrgico, e que 60% evoluem para hipotermia no período pós-operatório.
Causas para hipotermia
As drogas anestésicas atuam no centro de termorregulação, inibindo respostas ao frio como vasoconstrição e tremores musculares. Além de possuírem ação vasodilatadora.
Quando ocorre o fim da anestesia, a interrupção da infusão das drogas e a diminuição da concentração das mesmas no sistema nervoso central faz com que o mecanismo de termorregulação tenda a voltar ao normal, porém muitas drogas possuem efeito residual e meia vida longa, fazendo com que se prolongue a eficácia do mecanismo de regulação.
A hipotermia é considerada quando se atinge temperaturas abaixo de 36°C e pode ser leve (34°C -36°C), moderada (30°C-34°C) ou grave (abaixo de 30°C). E leva a diversas complicações pós-operatórias como alterações cardiovasculares, coagulopatias, aumento do risco de infecção, alterações hidroeletrolíticas, entre outras.
Apesar de todas essas evidências, ainda não é de costume utilizar rotineiramente monitorização para aferição de temperatura durante os procedimentos cirúrgicos. O diagnóstico precoce e utilização de medidas de aquecimento durante o ato cirúrgico é fundamental para que se evite complicações futuras.
Fatores de risco
Dentre os fatores de risco para a hipotermia os mais importantes estão relacionados à própria técnica anestésica. Estudos demonstraram que técnicas combinadas como anestesia geral e bloqueio de neuroeixo1 concomitante são mais propícias a desencadear hipotermia do que técnicas isoladas. Sendo a anestesia geral a de menor risco. Isso se deve à combinação dos efeitos diretos das drogas no centro termorregulador somado a ação vasoconstritora dos bloqueios espinhais.
O uso de opioides também tem íntima relação com a hipotermia intraoperatória, uma vez que agem no hipotálamo, quando administrados por via venosa, exercendo efeitos farmacológicos nos receptores mu do centro termorregulador assim como através dos receptores kappa periféricos da medula espinhal em bloqueios de neuroeixo.
A idade também é um fator de risco para a hipotermia3. Pacientes idosos possuem uma resposta ineficaz ao calor, resposta vasoconstritora diminuída, menos massa muscular assim como menor capacidade de produzir calor.
Fatores relacionados a cirurgia como tempo cirúrgico prolongado, cirurgias abertas, sangramento, maior exposição ao ambiente frio e mecanismos de irrigação contínua no pós-operatório, contribuem para o estabelecimento de hipotermia e sua perpetuação no período pós-operatório.
Sendo assim, a diminuição dos fatores de risco somados à aferição de rotina da temperatura nos pacientes cirúrgicos, principalmente durante a primeira hora do procedimento cirúrgico é fundamental para se evitar a queda da temperatura durante a cirurgia e consequentemente evitar as complicações pós-operatórias relacionadas a hipotermia. Uso de mantas e colchões térmicos, infusões aquecidas e aumento da temperatura do ambiente cirúrgico são medidas de suporte eficazes para manter o paciente aquecido. Essas medidas também devem ser mantidas durante o tempo em que o paciente permanece na recuperação pós anestésica4, uma vez que grande parte dos pacientes apresenta queda da temperatura no período pós-operatório também.
Vale muito ressaltar que a Hipotermia no paciente cirúrgico é:
Comum:
- Os pacientes perdem em média 3ºC durante a anestesia6,8.
- A maior perda é durante a primeira hora de anestesia8.
- A incidência de hipotermia é de 60 a 85% no pós-operatório dos pacientes que não utilizaram sistema de aquecimento por ar, por convecção9,11.
Custosa:
- Pacientes com hipotermia custam em média US$ 7.000 ao hospitais12.
- Apresentam 2,6 dias a mais de permanência hospitalar13.
Debilitante:
- Infecção de feridas aumentam 19% nos pacientes hipotérmicos13.
- Aumento de taxa de mortalidade em 31% nos pacientes hipotérmicos14,15.
Diante de todos estes pontos críticos, o conselho federal de medicina através da resolução 2174/17 dispõe sobre a prática do ato anestésico, definindo as condições de segurança correlacionadas à utilização de materiais e condutas que garantam uma anestesia segura.
Dentre suas considerações, é determinado:
“Art. 3º Entende-se por condições mínimas de segurança para a prática da anestesia a disponibilidade de:
I – Monitorização do paciente, incluindo:
c) Determinação da temperatura e dos meios para assegurar a normotermia em procedimentos com duração superior a 60 (sessenta) minutos e nas condições de alto risco, independentemente do tempo do procedimento (prematuros, recém-nascidos, história anterior ou risco de hipertermia maligna e síndromes neurolépticas).”15
Conheça as soluções da MA Hospitalar!
Referências bibliográficas
- Horn EP, Bein B, Broch O, et al. Warming before and after epidural block before general anaesthesia for major abdominal surgery prevents perioperative hypothermia: a randomised controlled trial. Eur J Anaesthesiol. 2016;33:334-340. doi: 10.1097/EJA.0000000000000369
- Gurunathan U, Stonell C, Fulbrook P. Perioperative hypothermia during hip fracture surgery: An observational study. J Eval Clin Pract. 2017;23:762-766.
- Mendonça FT et al. Fatores de risco para hipotermia pós‐operatória em sala de recuperação pós‐anestésica: estudo piloto prospectivo de prognóstico. Brazilian Journal of Anesthesiology. 2019 Mar-Abr; 69(2):122-130.
- Horosz B, Malec-Milewska, Małgorzata. Inadvertent intraoperative hypothermia. Anaesthesiology Intensive Therapy 2013, vol. 45, no 1, 38–43.
- Torossian, A. Thermal management during anaesthesia and thermoregulation standards for the prevention of inadvertent perioperative hypothermia. Best Practice & Research Clinical Anaesthesiology Vol. 22, No. 4, pp. 659–668, 2008.
- Matsukawa T, Sessler DI, Sessler, AM et al. Heat flow and distribution during induction of general anesthesia. Anesthesiology 1995; 82: 662–673.
- Kiekkas P, Poulopoulou, M, Papahatzi, A, Souleles, P. Effects of Hypothermia and shivering on Standard PACU monitoring of Patients. AANA Journal/Feb. 2005/Vol. 73 No 1
- Stewart SMB, Lujan E, Ruff CL. Incidence of adult hypothermia in the post anesthesia care unit. Periop Nurs Q. 1987;3:57-62.
- Vaughan MS, Vaughan RW, Cork RC. Postoperative hypothermia in adults: relationship of age, anesthesia and shivering to rewarming. Anesth Analg. 1981;60:746-751.
- Brown Mahoney, C, Odom J. Maintaining intraoperative normothermia: A meta-analysis of outcomes with costs. AANA Journal, April 1999; Vol.67, No 2.
- Kurz A, Sessler DI, Narzt E, et al. Postoperative hemodynamic and thermoregulatory consequences of intraoperative core hypothermia. J Clin Anesth. 1995;7:359-366
- Niven, DJ, Stelfox, HT, Laupland, KB. Hypothermia in Adult ICUs: Changing Incidence But Persistent Risk Factor for Mortality. J Intensive Care Med. Published online October 21, 2014.
- BRASIL. Entidades de Fiscalização do Exercício das Profissões Liberais / Conselho Federal de Medicina. RESOLUÇÃO 2.174, DE 14 DE DEZEMBRO DE 2017. Diário Oficial, Brasília, DF, 27 de fev. de 2018, seção 1, p. 75-84.
- https://pebmed.com.br/fatores-de-risco-para-hipotermia-perioperatoria/
Tradicionalmente, os anestesiologistas administram os gases e os agentes anestésicos (AA) ajustando manualmente as concentrações dos vaporizadores e os fluxos de gases frescos (FGF). Todavia, é tecnicamente possível realizar a anestesia de baixo fluxo de forma automática, através do controle expirado (ET) no final da expiração.
Com a evolução da pandemia, onde todos os recursos estão sendo direcionados de maneira integral na promoção de saúde e tratamento dos pacientes contaminados pela Covid-19 — todas as alternativas e tecnologias que possam vir a contribuir na amenização das consequências serão bem-vindas. E, cada vez mais, as inovações tecnológicas estão sendo implantadas com intuito de oferecer a melhor qualidade no atendimento de todos.
Para a área de anestesiologia, podemos contar com ferramentas que auxiliam no monitoramento seguro da técnica de anestesia de baixo fluxo para possibilitar o uso racional dos medicamentos anestésicos, conforme recomenda a Sociedade Brasileira de Anestesiologia (SBA), principalmente neste cenário atual. Além disso, o custo e a poluição ambiental são duas das principais preocupações com a anestesia geral, que podem estar sendo solucionadas também com esse recurso.
Primeiramente, para trabalhar com segurança, você deve se lembrar dos princípios básicos farmacológicos e fisiológicos subjacentes. É importante entender como as concentrações de gás se comportam em um sistema circular e como elas dependem de diferentes fluxos de gases frescos (FGF).
Na prática, o anestesista precisa conhecer os possíveis riscos e benefícios de uma determinada técnica. E, em especial, na anestesia com baixo fluxo e mínimo, o médico deve compreender a importância do monitoramento da ventilação e da medição das concentrações de gases e agentes anestésicos.
A anestesia geral inalatória é aplicada e monitorada por um anestesista. Comumente, a técnica de baixo fluxo é realizada manualmente, ou seja, o médico define o alvo da concentração de oxigênio, necessitando alterar quando preciso a fração de gás inspirado (FiO²), o fluxo de gás fresco e as concentrações do vaporizador para garantir a aplicação ideal da anestesia, minimizando o desperdício de anestésico e possibilitando maior segurança para o paciente.
No entanto, existe uma alternativa de realizar essa técnica de maneira mais eficaz e segura que é através da automação, ou seja, o anestesista irá definir o alvo da fração expirada de oxigênio (EtO²) e os valores da fração expirada de agente anestésico (EtAA) e a máquina ajustará automaticamente a administração do agente e o FGF total para atingir e/ou manter os valores estabelecidos, otimizando o fluxo de trabalho do anestesista.
ANESTESIA DE BAIXO FLUXO
A anestesia com baixo fluxo é uma técnica que usa um sistema de reinalação para retornar pelo menos 50% do valor exalado de gases para o pulmão do paciente após a eliminação de dióxido de carbono (CO²). Sua popularidade e uso estão aumentando em todo o mundo devido à crescente importância do controle de custos, maior consciência ambiental e a disponibilidade de equipamentos avançados de anestesia.
Devido ao seu baixo custo, a anestesia de baixo fluxo está se tornando cada vez mais difundida. Body et al. relataram que a taxa de fluxo de gás fresco usada em seu hospital foi de 1,8 L/min. Tohmo et al. relataram que a frequência de uso do sistema de reinalação para a prática de anestesia na Finlândia aumentou de 62% em 1995 para 83% em 2002, enquanto a taxa de fluxo de gás fresco diminuiu de 3L/min para 1-2L/min no mesmo tempo.
Kennedy et al. avaliaram as mudanças no fluxo de gás fresco em um hospital de treinamento na Nova Zelândia em 2001 e 2006, e relataram que a taxa média de fluxo de gás fresco foi de 1,5 L / min em 2001 e diminuiu para 1,27 L / min em 2006, representando uma redução de 35% no fluxo de gás fresco em 4 anos.
REQUISITOS BÁSICOS PARA ANESTESIA DE BAIXO FLUXO
A anestesia de baixo fluxo pode ser definida como uma técnica em que o FGF é adaptado para atender a necessidade do oxigênio do paciente (cerca de 200mL/min) e de anestésicos voláteis. Além disso, existe a cal sodada (absorvedor de CO²) que faz a remoção do CO² do circuito respiratório.
Para a realização da técnica de anestesia de baixo fluxo, existem alguns requisitos técnicos que são importantes para sua execução segura. Dentre eles, podemos citar:
- Sistema de respiração circular com absorção de CO²;
- Medidores de fluxo precisos para ajuste de fluxos de gás fresco abaixo de 1,0L/min;
- Vaporizadores precisos, capazes de fornecer de maneira confiável concentrações de agentes anestésicos voláteis com FGF abaixo de 1,0L/min;
- Deve haver um sistema respiratório estanque aos gases. O teste de vazamento recomendado deve ser abaixo de 150mL/min no teste de pressão de 30cmH²O. Normalmente, o fole ascendente que não sobe até o topo da câmara do fole pode indicar vazamento no sistema respiratório. Outra indicação de vazamento no circuito pode ser que o ALARME BAIXO da pressão de pico das vias aéreas se tornaria ativo. Além disso, se os loops de espirometria exibidos na tela do monitor não fecharem corretamente, isso também pode indicar um vazamento;
- O sistema respiratório deve ter volume interno mínimo e um número mínimo de componentes e conexões.
- O monitoramento contínuo de gás deve ser empregado. As concentrações de gás inspiratório e expiratório devem ser medidas a cada ciclo respiratório.
Além dos requisitos acima, o monitoramento da ventilação deve sempre ser empregado. A medição do CO² expirado fornecerá essa informação e ajudará a controlar a ventilação alveolar do paciente. Para controlar os volumes do sistema respiratório e a mecânica pulmonar do paciente, informações adicionais podem ser obtidas monitorando as pressões das vias aéreas, os volumes respiratórios e os loops de espirometria.
SISTEMA CIRCULAR E SEUS COMPONENTES
O uso de agentes anestésicos inalatórios em circuito fechado ou semifechado leva à reinalação dos agentes anestésicos voláteis. Isso leva à diferença na concentração fornecida e inspirada de agentes anestésicos voláteis, dependendo do fluxo de gás fresco (FGF).
E, dependendo do FGF entregue, o sistema circular pode funcionar em diferentes formas.
- A anestesia de alto fluxo usa um FGF, que está próximo do volume-minuto do paciente (em média 3 a 6L/min em um adulto normal);
- A anestesia com baixo fluxo usa um FGF de menos da metade do volume-minuto do paciente, o que é mais frequentemente inferior a 3,0L/min em média em um adulto normal;
- Na anestesia com fluxo mínimo, o FGF é reduzido para 0,5L/min.
- Na anestesia de sistema fechado, o FGF é adaptado para igualar a necessidade do oxigênio do paciente e agentes anestésicos.
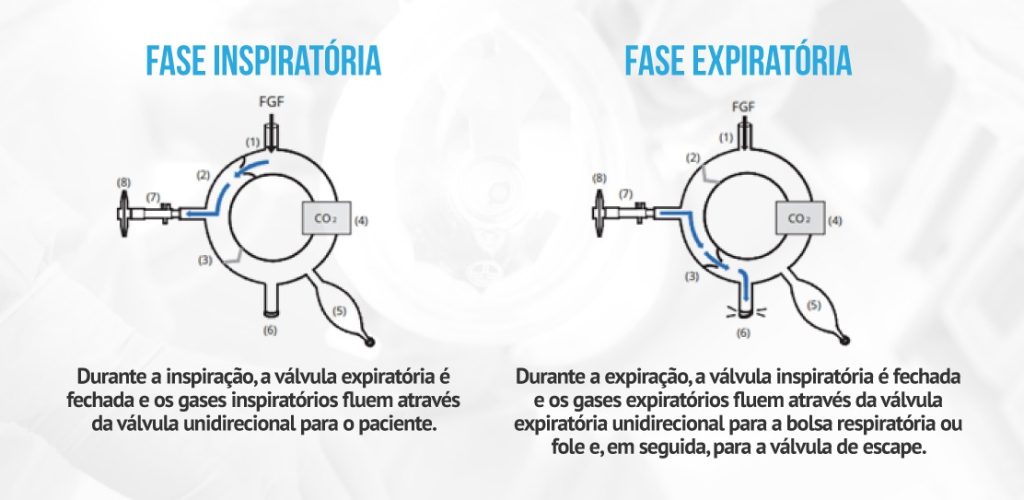
A lista de componentes de um sistema circular seguirá:
- Entrada de FGF
- Ramo inspiratório com válvula unidirecional
- Ramo expiratório com válvula unidirecional
- Absorvente para remoção de CO²
- O volume do reservatório para ventilação com pressão positiva, tanto com bolsa manual quanto com fole do ventilador, pode ser conectado aqui.
- Válvula de exaustão para eliminação de gases residuais
- Peça em Y do paciente, sensor de fluxo de espirometria e mostrador de gás
- Filtro bacteriano pode ser adicionado aqui
QUAIS AS VANTAGENS DO SISTEMA CIRCULAR?
A vantagem dos sistemas circulares é que eles permitem o uso de FGF baixo ou mínimo. São, no entanto, sistemas estruturalmente complexos e quando baixo FGF é usado, as concentrações de gás inspirado não se relacionam intimamente com as concentrações de FGF administradas pela máquina anestésica. Monitores de gás sofisticados, integrados em máquinas anestésicas modernas, são, portanto, essenciais.
Em resumo, podemos destacar as seguintes vantagens:
- Baixos custos;
- Diminui a contaminação;
- Maior precisão na medida dos volumes;
- Monitoração direta do consumo de O²;
- Melhor umidificação.
QUANTO TEMPO POSSO USAR A CAL SODADA (ABSORVEDOR DE CO²) SEM SUBSTITUIÇÃO?
A cal sodada faz parte da prática clínica diária do anestesiologista. É ela que permite o uso de baixo fluxo de gases frescos a fim de reduzir o consumo de anestésico, manter a temperatura corporal do paciente, conservar a umidade das vias aéreas e evitar poluição na sala de cirurgia.
Devido ao menor consumo de gases e de anestésicos, torna-se um aliado econômico da unidade hospitalar. Além de manter a umidade do ar inalado, evitando os efeitos deletérios de gases secos, tais como ressecamento, inflamação e perda dos movimentos ciliares, leva à redução do fluxo, causando diminuição da complacência pulmonar. A absorção do CO² é uma reação química exotérmica. No sistema em circuito fechado, a água e o calor da reação contribuem para a umidificação e o aquecimento da mistura.
A capacidade de absorção de CO² é baseada no volume-minuto do paciente, o volume da cal sodada e a taxa de FGF selecionada. Quanto menor o FGF, mais o gás é reciclado no circuito, maior a remoção de CO² pelo absorvedor. Contudo, o baixo FGF, levará a necessidade de troca da cal sodada mais vezes ao dia.
ENTÃO, QUANDO A CAL SODADA DEVE SER TROCADA?
A troca da cal sodada deve ocorrer quando houver um aumento considerável nos valores medidos da fração inspirada de CO² (FiCO²) e sem alterações significativas nas configurações da ventilação do paciente.
Outro ponto visível que indica a troca da cal sodada é a mudança da coloração para roxa. Quando a cor da cal sodada muda permanentemente isso sinaliza a hora de trocar o absorvedor. Porém, é importante se atentar que depois de algum tempo, essa mudança de cor pode desaparecer. Portanto, é melhor trocar o absorvedor por conta própria em vez de deixá-lo durante a noite, pois as pessoas no dia seguinte podem não estar cientes das informações sobre a capacidade do absorvedor.
VOCÊ SABIA?
O potencial de superfornecimento ou subfornecimento tanto do agente quanto da concentração final de oxigênio é o grande desafio da atualidade na anestesia, mas a automação pode ajudar você a superá-lo. A otimização do fornecimento de agente anestésico e de oxigênio pode ajudar você a aumentar a qualidade do atendimento de seus pacientes, incluindo os que precisam de cuidados extras.
AFINAL, O QUE É ANESTESIA DE BAIXO FLUXO AUTOMÁTICA?
A anestesia inalatória controlada pelo alvo da EtO2, também chamada de controle expirado, é um sistema de realização de anestesia disponível nas máquinas mais recentes. Nessa modalidade a máquina ajusta automaticamente o fluxo de gás fresco total e a concentração do agente anestésico para atingir os níveis desejados definidos pelo anestesista.
Automatizar o processo de monitoramento e ajuste das concentrações de gás encurta a indução anestésica e resulta em concentrações anestésicas arteriais e cerebrais mais estáveis, estabilizando o nível de anestesia. Também minimiza a quantidade de gás fresco e anestésico desperdiçado, reduzindo os custos de saúde e a carga ambiental.
O consumo de agentes inalatórios não depende apenas do FGF, mas também da solubilidade relativa do gás. Assim, o monitoramento das pressões parciais dos agentes inalados dentro do sistema respiratório é desejável.
O uso de agentes anestésicos inalatórios em circuito fechado ou semifechado leva à reinalação dos agentes anestésicos voláteis. Isso leva à diferença na concentração fornecida e inspirada de agentes anestésicos voláteis, dependendo do FGF.
COMO FUNCIONA?
O circuito respiratório interno da anestesia consiste em um misturador de gás que controla a quantidade de oxigênio e ar ou óxido nitroso fornecido ao paciente, dependendo das configurações.
As válvulas seletoras abrem de acordo com o modo de seleção. Os sensores monitoram continuamente o misturador de gás. O gás misturado sai do misturador e flui para o vaporizador eletrônico, onde a vaporização do agente ocorre usando um fluxo de desvio convencional e o princípio de vaporização livre. Então, o gás comum com o agente flui através das válvulas de entrada e saída.
No entanto, a entrega real do agente é controlada pelo “vaporizador eletrônico” interno. Este dispositivo regula o fluxo de desvio e controla as válvulas de entrada e saída para atingir a saída desejada no gás fresco. Vários sensores no caminho do gás monitoram constantemente o fluxo e a pressão para garantir a concentração de vapor desejada no FGF, mesmo em taxas mínimas. O consumo dos vários gases inalados é calculado automaticamente pelo software computadorizado embutido na máquina.
E QUAIS AS VANTAGENS DA AUTOMAÇÃO?
Dentre as vantagens da anestesia de baixo fluxo automática, podemos destacar:
- Com a facilidade da automação, a carga de trabalho é reduzida para o anestesista, possibilitando que ele se preocupe com outros pontos;
- Efetividade na entrega de agentes, otimizando a entrega do FGF;
- Guarda hipóxica inteligente (mínimo 25%) com a manutenção de fluxos baixos;
- Economia de gases e AA, impactando nos custos e poluição ambiental;
Sabemos que o consumo de medicamentos anestésicos está excessivo devido ao problema mundial de saúde que estamos enfrentando desde 2020 por conta da Covid-19. E, com isso, a técnica de anestesia de baixo fluxo automática é uma alternativa eficaz e segura para racionalizar o uso desses medicamentos, além de contribuir na redução dos custos hospitalares e poluição ambiental, bem como oferecer uma maior segurança no atendimento do paciente.
Leia também nossa outra publicação sobre a anestesia de baixo fluxo.
REFERÊNCIAS BIBLIOGRÁFICAS
ARAI, L. A. C; AZEVEDO, R. B. Contaminação do Aparelho de Anestesia por Agentes Patógenos. Rev Bras Anestesiol. Vol. 61, nº 1, 2011: 50-59.
BODY, S. C; FANIKOS, J; DePEIRO, D. et al. Individualized feedback of volatilee agent use reduces fresh gas flow rate, but fails to favorably affect agent choice. Anesthesiology 1999;90:1171–5.
Tohmo H, Antila H. Increase in the use of rebreathing gas flow systems and in the utilization of low fresh gas flows in Finnish anaesthetic practice from 1995 to 2002. Acta Anaesthesiol Scand. 2005 Mar;49(3):328-30.
Kennedy RR, French RA. Changing patterns in anesthetic fresh gas flow rates over 5 years in a teaching hospital. Anesth Analg. 2008;106:1487–90.
POTDAR, M. P; KAMAT, L. L; SAVE, M. P. Cost efficiency of target-controlled inhalational anesthesia. Journal of Anaesthesiology Clinical Pharmacology. April-June, 2014. Vol 30.
HERBERT, L; MAGEE, P. Circle systems and low-flow anaesthesia. BJA Education. Volume 17, Number 9, 2017.
NICE. End-tidal Control software for use with Aisys closed circuit anaesthesia systems for automated gas control during general anaesthesia. Medtech innovation briefing. 2014.
KALLI, I. Clinical performance of electronic control for Aisys™, to automatically adjust fresh gas, agent and oxygen. Helsinki University Central Hospital, Helsinki, Finland.
A evolução na área de Anestesiologia é marcada pelo avanço de tecnologias cada vez mais inovadoras que auxiliam no melhor cuidado do nosso principal cliente: o paciente. E você acha possível evitar o consumo excessivo de agentes anestésicos inalatórios, além de preservar e impactar na segurança do paciente?
Para compreendermos melhor o benefício da ferramenta Ecoflow, é importante entender a correlação do impacto do consumo de agentes anestésicos inalatórios versus custos hospitalares e o conhecimento das possíveis complicações pulmonares pós-operatórias.
Entramos no segundo ano consecutivo de enfrentamento da Covid-19, que em comparação ao ano de 2020, os casos atuais de contaminação por esse vírus fatal estão mais graves, prolongados e com alta taxa de mortalidade.
Por consequência, com o elevado número de casos graves, houve um aumento significativo no consumo de medicamentos sedativos, analgésicos e bloqueadores neuromusculares. Porém, atualmente, existe um outro grande problema: a falta de fármacos para sedar e anestesiar os pacientes.
Considerando que os fármacos essenciais para as técnicas anestésicas estão em falta ou em ameaça de falta em diversas regiões do país, a Sociedade Brasileira de Anestesiologia (SBA) recomenda o uso racional de fármacos em anestesia e sedação, principalmente, nos procedimentos cirúrgicos eletivos. Os principais fármacos envolvidos são os de uso comum pela anestesia e pela terapia intensiva: agentes indutores, tranquilizantes, bloqueadores neuromusculares, opioides, analgésicos, anestésicos locais, anestésicos inalatórios e agonistas dos receptores alfa, entre outros.
O objetivo dessa recomendação da SBA é alertar os anestesiologistas e demais médicos, principalmente neste momento de pandemia, a encontrarem medidas que possam minimizar ou contornar a escassez desses fármacos, devido ao consumo excessivo pela necessidade de tratamento prolongado dos pacientes portadores da Covid-19.
Segundo a Organização Mundial de Saúde, a segurança anestésica é definida como o “conjunto de ações realizadas pelo anestesiologista, que visa a redução da insegurança anestésica por meio da inspeção formal do equipamento, da checagem dos medicamentos e do risco anestésico do paciente antes da realização de cada cirurgia”.
AGENTES ANESTÉSICOS INALATÓRIOS E SUAS PROPRIEDADES
Os anestésicos inalatórios, também denominados de halogenados, são administrados via pulmonar, difundem-se para o sangue e, uma vez diluídos, alcançam as suas zonas de atuação a nível do Sistema Nervoso Central (SNC) através da circulação sanguínea, sendo eliminados posteriormente, na sua maior parte, outra vez por via pulmonar.
A potência anestésica dos gases é dada pela Concentração Alveolar Mínima (CAM). Esta pode ser definida como a concentração mínima de anestésicos nos alvéolos que produz imobilidade em 50% dos doentes expostos a estímulos dolorosos (por exemplo à incisão cirúrgica). A CAM é, portanto, usada para comparar os diferentes anestésicos voláteis bem como suas respectivas eficácias. A duração da anestesia geral, o tamanho e peso do paciente não influenciam o valor da CAM, mas a idade e a temperatura corporal podem influenciar.
Esses anestésicos também têm importância nos parâmetros provenientes do sistema cardiorrespiratório (concentração e ventilação alveolar, débito cardíaco e perfusão cerebral) pois estes influenciam a absorção, distribuição e eliminação dos anestésicos inalatórios.
Existem vários anestésicos voláteis que podem ser usados para a indução e manutenção da anestesia geral. Os mais utilizados são o Isoflurano e o Sevoflurano.
ISOFLURANO
Indicação: Manutenção da anestesia geral (reduz o nível de consciência).
Formas de apresentação: Líquido volátil claro, incolor em temperatura ambiente, deve ser armazenado em frasco vedado. Não é inflamável e não é explosivo em misturas de ar e oxigênio. Isoflurano é fornecido em embalagens contendo 1 frasco de 100 ml ou 250 ml de líquido volátil (não contém excipientes).
Diluição para infusão: Administração via vaporizador preferencialmente do tipo calibrado, agente específico para Isoflurano ou vaporizador do tipo não calibrado para uso com múltiplos agentes (universal).
Pontos importantes: É um anestésico largamente utilizado. Doses: Usualmente, é mantida entre 0,5 e 1 CAM (0,6% – 1,2% – concentração expirada), dependendo dos outros anestésicos utilizados.
SEVOFLURANO
Indicação: Indução e manutenção de anestesia geral em pacientes pediátricos ou adultos, em procedimentos cirúrgicos hospitalares ou ambulatoriais.
Formas de apresentação: Líquido volátil claro, incolor em temperatura ambiente, deve ser armazenado em frasco vedado. Não é inflamável e não é explosivo em misturas de ar e oxigênio. Sevoflurano é fornecido em embalagens contendo 1 frasco de 100 ml ou 250 ml.
Diluição para infusão: Administração via vaporizador preferencialmente do tipo calibrado, agente específico para Sevoflurano ou vaporizador do tipo não calibrado para uso com múltiplos agentes (universal).
Pontos importantes: É um anestésico largamente utilizado e idealmente conveniente para indução de pacientes com dificuldades para abordagem das vias aéreas. Doses: Usualmente, é mantida entre 0,5 e 1 CAM (1% – 2% – concentração expirada), dependendo dos outros anestésicos utilizados.
COMO A ANESTESIA DE BAIXO FLUXO PODE AJUDAR NESSE CENÁRIO?
A introdução de novos agentes anestésicos voláteis com baixa solubilidade e baixa potência anestésica reforçou a necessidade de reduzir o consumo de agente anestésico diminuindo o fluxo de gás fresco (FGF). Além dos benefícios econômicos ou ambientais, o baixo fluxo pode ter um impacto positivo na qualidade do atendimento ao paciente.
A maior parte dos gases anestésicos, em média mais de 80%, são desperdiçados quando o FGF de 5,0 L/min é utilizado. Vários estudos também comprovam que o uso de técnicas de anestesia com baixo ou mínimo fluxos podem reduzir drasticamente os custos anuais de anestésicos voláteis. Normalmente, a redução do FGF de 3,0 L/min para 1,0 L/min resulta em uma economia de cerca de 50% do consumo total de qualquer agente anestésico volátil.
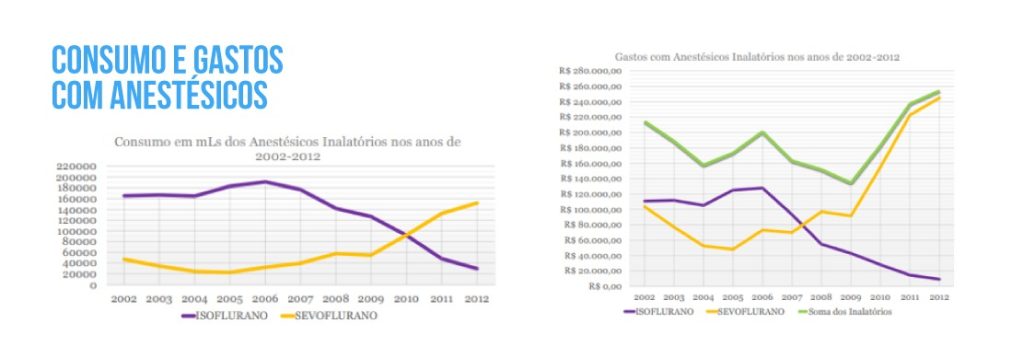
Foi realizado um estudo para identificar o perfil e o impacto econômico do consumo dos anestésicos inalatórios no Serviço de Anestesiologia e Medicina Perioperatória (SAMPE) no período de 2002 a 2012 no Hospital de Clínicas de Porto Alegre. Podemos verificar nos gráficos abaixo que o estudo demonstrou um aumento substancial no consumo do anestésico Sevoflurano, refletindo em gastos progressivamente mais elevados com esse fármaco. E, estratégias para minimizar o custo dos novos anestésicos inalatórios como o uso de técnicas de fluxo basal e redução efetiva do tempo da sala de recuperação são exemplos das medidas sugeridas pelo estudo para reduzir esse índice.
Outro ponto a ser considerado, também, é que nas técnicas anestésicas com fluxos mais altos, geralmente, os gases são secos e úmidos. Já nas de fluxos mais baixos ou mínimos, os gases fornecidos que recirculam no circuito fechado tornam-se mais quentes e úmidos. E, respirar gases quentes e úmidos durante a anestesia é benéfico para o paciente por vários motivos.
• Melhora a preservação da temperatura corporal do paciente durante a cirurgia;
• Prevenção da perda de calor central para a periferia por causa da vasodilatação durante a anestesia;
• Evita tremores pós-operatórios;
• Possibilita manter a humidade ideal do paciente;
• Evita o ressecamento das vias aéreas superiores e inferiores durante a intubação.
A maioria das máquinas de anestesia modernas são equipadas com o sistema circular de reinalação, o que permite uma redução considerável do FGF. Os benefícios disso tornam-se mais evidentes quando o FGF é reduzido para menos da metade do volume-minuto do paciente, geralmente, para menos de 3,0 L/min.
E, as técnicas de FGF baixo afetam a cinética do gás no sistema, especialmente, quando o FGF é inferior a 1,0 L/min. Para tanto, torna-se necessário o monitoramento das concentrações de gases inspirados e expirados. Esse monitoramento não garante apenas a segurança do paciente, mas também facilita a administração precisa de gás para o paciente.
QUAIS AS COMPLICAÇÕES PULMONARES PÓS-OPERATÓRIAS DO USO EXCESSIVO DE ANESTÉSICOS E VENTILAÇÃO MECÂNICA PROLONGADA?
Os procedimentos cirúrgicos costumam estar associados a mudanças circunstanciais dos componentes fisiológicos e metabólicos que garantem a homeostasia. Elas variam de acordo com o biótipo do paciente e do tipo de cirurgia e, em situações de trauma, dependem ainda da gravidade e extensão das lesões.
A iatrogenia em procedimentos cirúrgicos abrange uma gama de complicações e sendo de responsabilidade tanto dos cirurgiões quanto dos anestesistas fazerem o que estiver aos seus alcances para evitar uma complicação, buscando sempre o aperfeiçoamento de suas técnicas bem como a utilização de ferramentas que possam auxiliar nesse processo.
Por exemplo, uma anestesia com alto fluxo de gases e muito profunda pode provocar uma série de complicações pulmonares ao paciente.
Dentre essas complicações, podemos destacar:
• Insuficiência respiratória;
• Exacerbação das condições respiratórias pré-existentes;
• Tromboembolismo pulmonar;
• Atelectasia pulmonar (colabamento alveolar);
• Pneumonia;
• Edema pulmonar;
O QUE É ECOFLOW?
É uma ferramenta que auxilia o anestesista a monitorar o “alvo” pré-ajustado de O2 e, no decorrer da cirurgia ou o baixo fluxo de gases, a máquina sugere a FiO2 alvo, permitindo que o médico ajuste ou não esse alvo conforme a necessidade. Com ela é possível verificar o custo do agente anestésico consumido em tempo real.
A sua utilização monitora a fração inspirada de O2 (FiO2) possibilitando mais segurança ao anestesista e paciente durante a técnica de baixo fluxo para evitar a entrega de mistura hipóxica. Essa solução está presente nos aparelhos de anestesia da GE Healthcare: Carestation 650, Carestation 750, Avance S2 e Aisys.
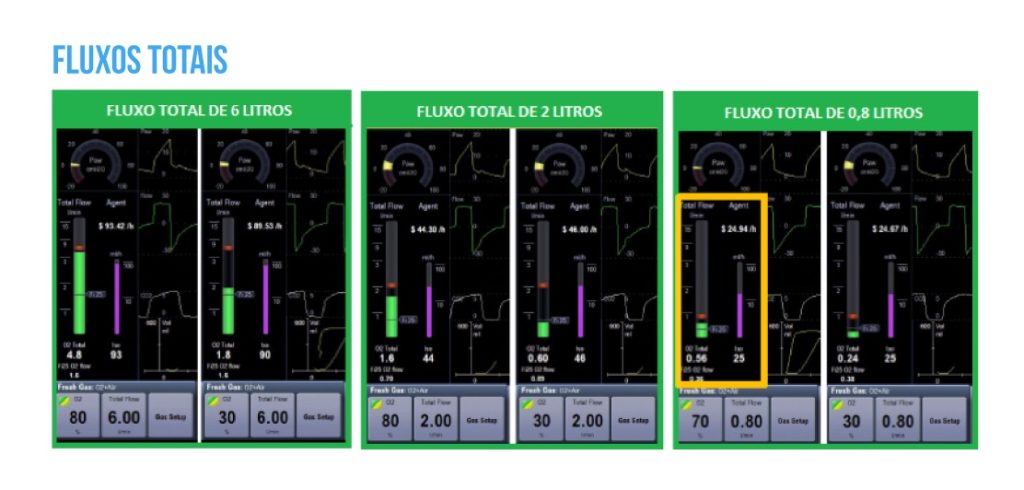
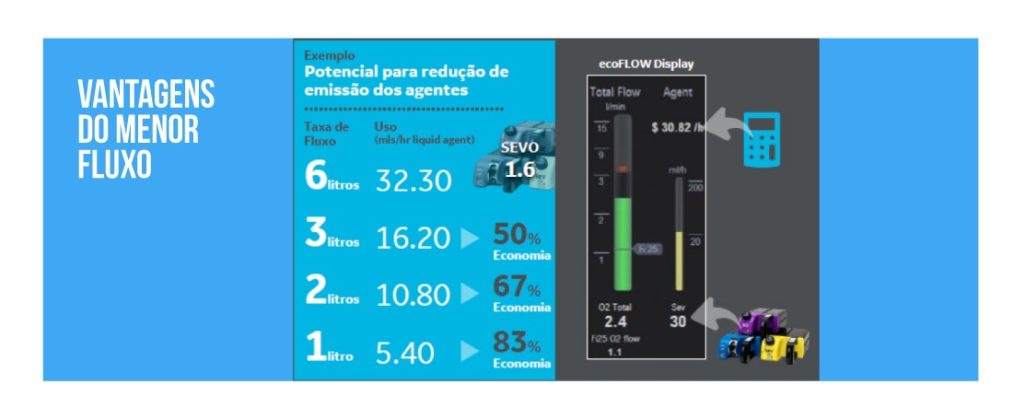
No exemplo 1, para um FGF total de 6 L/min e 4,8 L/min de O2 no circuito, a máquina sugere como alvo 1,6 L/min de O2 para manter uma guarda hipóxica de FiO2 25%. Já no exemplo 2, para um FGF total de 2 L/min e 1,6 L/min de O2 no circuito, é sugerido como alvo 0,7 L/min para manter uma guarda hipóxica de FiO2 25%. E, no exemplo 3, para um FGF total de 0,8 L/min e 0,56 L/min de O2, sugere-se como alvo 0,36 L/min para manter uma guarda hipóxica de FiO2 25%.
VOCÊ SABIA?
A quantidade de gás que entra no sistema de evacuação de gases é determinada pelo fluxo total de gases frescos (FGF). Quando o FGF excede o necessário para o paciente, os gases excedentes entram no sistema de evacuação, contaminando o meio ambiente. Por esse motivo, com a utilização de fluxos mais baixos é possível minimizar o impacto ambiental, além de economizar o uso do agente anestésico.
ECOFLOW VERSUS FIO2 SEGURA
Com o EcoFlow, é possível ajustar o O2 necessário ao metabolismo do paciente de acordo com a “FiO2 segura”, sendo monitorado o circuito do paciente e o sistema circular para determinar a precisão de O2 no FGF para atingir o valor ideal para o metabolismo.
Essa ferramenta considera a mistura atual de gases no circuito, incluindo agentes anestésicos e define um sinalizador no FGF total para mostrar o quanto de O2 precisa ser entregue.
A FiO2 segura pode ser ajustada entre 25% e 50%.
SAIBA COMO ESSA SOLUÇÃO PODE OTIMIZAR OS CUSTOS COM SEGURANÇA AO PACIENTE
• Possibilita o ajuste da concentração apropriada de O2 para evitar a entrega de mistura hipóxica ou excessiva para o paciente;
• Possibilita a redução do fluxo de gases sem comprometer a qualidade da entrega de agentes inalatórios para uma economia potencial e proteção ambiental;
• Possibilita que equilibre o FGF com a FiO2 para estarem de acordo com os indicadores de segurança;
• Ajuda os médicos anestesistas a amenizar os riscos de complicação pulmonar pós-operatória e reduzir os riscos de complicações causadas por falhas na entrega dos gases;
• Cuidados sob medida para os pacientes em anestesia;
• Ajuda a reduzir o gasto com agentes anestésicos;
• Ajuda a proteger os investimentos;
• Ajuda na economia dos gases.
Mediante o cenário atual que estamos vivendo, onde o consumo com medicamento anestésico está elevado e, a SBA recomenda o seu uso racional, o Ecoflow é uma solução que pode contribuir muito para amenizar essa situação, evitando o consumo excessivo desnecessário. E, como já visto, a redução no uso de agentes anestésicos, irá impactar tanto na economia hospitalar e poluição ambiental quanto na preservação da segurança do paciente.
Outro ponto importante, com a utilização da anestesia de baixo fluxo, é a redução da poluição do meio ambiente.
Para saber mais sobre essa solução, clique aqui.
REFERÊNCIAS BIBLIOGRÁFICAS
- MARQUES, F. P. Análise do perfil dos consumos de gases frescos e anestésicos, durante a anestesia geral, em circuito fechado. Projeto de Mestrado Integrado em Engenharia Biomédica Coimbra, 2008.
- BRENNER, C. Q. Q; FELIX, E. A. Perfil de consumo e impacto econômico dos anestésicos inalatórios na última década no Serviço de Anestesiologia e Medicina Perioperatória do Hospital de Clínicas de Porto Alegre. Serviço de Anestesiologia e Medicina Perioperatória (SAMPE) do Hospital de Clínicas de Porto Alegre. Departamento de Cirurgia da Universidade Federal do Rio Grande do Sul (UFRGS)
- FUTIER et al. Perioperative Positive Pressure Ventilation: An Integrated Approach To Pulmonary Care. Anesthesiology. 2014. 121:400-8
- HUANG, J. Enhanced Recovery After Surgery (ERAS) Protocols and Perioperative Lung Protection. J Anesth and Perioper Med. 2014. 1: 50-56
LINKS
Uso racional de fármacos em anestesia
Em anestesiologia, a busca pela segurança e qualidade do controle tanto do adormecer quanto do despertar do paciente, bem como no alívio da dor durante o procedimento cirúrgico, se tornam possíveis devido ao aprimoramento das técnicas, dos medicamentos e das inovações de monitoramento.
A evolução da anestesia e o desenvolvimento de novos medicamentos e aparelhos deram condições para que as novas técnicas cirúrgicas, que provavelmente seriam letais no passado, hoje sejam realizadas com segurança.
Embora sejam comprovadas e amplamente difundidas, as vantagens oferecidas pela técnica do fluxo basal de gases, a propagação do método como rotina entre as técnicas anestésicas, encontra obstáculos diversos, primeiramente pela divergência no conceito de fluxo baixo de gases ou mínimo fluxo de gases e por ser considerada por muitos como complexa na execução.
Vamos entender mais sobre esse assunto e mudar de opinião?
VOCÊ SABE O QUE SIGNIFICA ANESTESIA?
1) Consiste em um “estado não natural, em que a capacidade de reter memória, bem como de discernir e reagir a estímulos lesivos é controlada de forma reversível por meio de uma variedade de medicações e técnicas.” 2) É o estado de total ausência de dor e outras sensações durante uma cirurgia, exame diagnóstico ou curativo. Ela pode ser geral, isto é, para o corpo todo; ou parcial, também chamada regional, quando apenas uma região do corpo é anestesiada.
COMO SURGIU A ANESTESIA COM BAIXO FLUXO?
O nascimento da anestesia cirúrgica moderna foi marcado pelo médico inglês John Snow. Dr. Snow ficou muito conhecido por seu trabalho epidemiológico a respeito da cólera e pela introdução da medicina higiênica — mas também poderia ser indicado como o primeiro anestesiologista de verdade.
No final do século XIX, John Snow iniciou a anestesia inalatória com baixo fluxo de gases com a intenção de reduzir o consumo e evitar a poluição dos anestésicos, conseguindo diminuir bastante o odor do clorofórmio e do éter nas salas de cirurgias. Ele criou um aparelho experimental de circuito fechado, no qual o paciente respirava oxigênio enquanto o dióxido de carbono exalado era absorvido por hidróxido de potássio.
Como era seu estilo, aprofundou-se no estudo e na compreensão dos anestésicos voláteis. Ao contrário de outros médicos anestesistas, Dr. Snow não estava preocupado com o seu papel e seu possível legado para a medicina, mas com a segurança e a administração correta da anestesia. Sua atitude calma e atenta na sala de cirurgia — e o foco no bem-estar do paciente, e não no seu orgulho — é um modelo a ser imitado.

O QUE É ANESTESIA COM BAIXO FLUXO?
A técnica de anestesia inalatória com baixo fluxo consiste na redução do uso de gases e agentes anestésicos durante um procedimento cirúrgico, ou seja, utilizar apenas o necessário para que o paciente seja anestesiado. Sua utilização ajuda na previsão do volume anestésico usado durante o ato anestésico, além da economia dos agentes. As anestesias de baixo fluxo e de fluxo mínimo se caracterizam pela vazão de pequenos volumes no fluxo de gás fresco em litros por minuto alimentando o circuito de gases do equipamento de anestesia. O fator diferencial é que o fluxo de gás fresco é claramente menor que o volume-minuto respiratório do paciente.
Em 1954, Foldes estabeleceu o conceito de baixos fluxos como sendo o fluxo de admissão de gases (FAG) de 1 L.min-1. Já, Virtue, em 1974, estabeleceu outro importante conceito de fluxos mínimos em que o FAG era de 0,5 l.min-1.
VOCÊ SABIA?
Você sabia que a redução do fluxo de gás fresco abaixo de 1L/min em circuito fechado está associada a vários benefícios durante a fase de indução anestésica inalatória? Dentre eles, se torna possível administrar volumes adequados para o paciente ser anestesiado, com a otimização de todo o vapor anestésico gerado pelo sistema de vaporização e sem o desperdício para um sistema de exaustão ou eliminado na própria sala. O sistema circular fechado durante a manutenção anestésica permite a reinalação quase total de todos os gases e vapores expirados, com exceção do CO2, que é absorvido pela cal sodada.
POR QUE UTILIZAR?
Dentre os benefícios do uso da prática de anestesia com fluxo basal de gases frescos, podemos destacar:
- Conserva a umidade e temperatura das vias aéreas
- Conserva o calor corporal do paciente
- Promove a redução na poluição do ambiente
- Permite uma melhor previsão do volume anestésico utilizado
- Otimiza o consumo de agentes anestésicos inalatórios
- Segurança para o paciente
- Reduz o risco das complicações pulmonares no pós operatório
- Melhor recuperação do paciente
- Possibilita uma melhor monitorização dos parâmetros fisiológicos do paciente
- Reduz o custo anual com gases e agentes anestésicos para a instituição.
No estudo de BILGI et al. podemos verificar que a função respiratória na técnica anestésica de baixo fluxo é melhor quando comparada à de alto fluxo. E, também, de acordo com FONSECA et al. nota-se que variações no consumo de oxigênio podem indicar alterações diretas no débito cardíaco. Desta forma, com a técnica de fluxo basal de gases, o anestesiologista mantém a fisiologia corporal e controla com facilidade a função pulmonar e cardiovascular.
Alguns estudos comprovam que há uma redução significativa nos custos anuais de agentes anestésicos com o uso de baixo fluxo. Por exemplo, uma redução de 3L/min para 1L/min resulta em uma economia de aproximadamente 50% no consumo de agentes anestésicos inalatórios. Segundo o estudo de BORGES e SARAIVA, os principais agentes anestésicos inalatórios foram testados na técnica de baixo fluxo e, excluindo as particularidades voláteis de cada um, foi possível verificar um menor consumo dos gases durante a indução anestésica.
Dessa forma, podemos concluir que a técnica de anestesia com baixo fluxo de gases durante a indução anestésica traz muitos benefícios tanto para o paciente quanto para a instituição hospitalar. Em destaque, a possibilidade de maior segurança e melhor recuperação para o paciente no pós operatório bem como uma economia significativa no custo anual com os agentes anestésicos.
A MA Hospitalar representa a GE Healthcare — empresa líder global em tecnologia médica, oferecendo um amplo portfólio de soluções completas para o melhor atendimento ao paciente. Dentre elas, destacam-se os aparelhos de anestesia que permitem realizar a técnica de baixo fluxo durante um procedimento cirúrgico. Os modelos: Carestation 650, Carestation 750, Avance e Aisys são soluções completas em anestesia que possuem uma ferramenta para a realização dessa técnica com qualidade e segurança tanto para o médico anestesista quanto para o paciente.
Gostaria de saber mais sobre o assunto? Assista ao nosso vídeo sobre o ECOFlow!
REFERÊNCIAS BIBLIOGRÁFICAS
- BORGES, M. M. J. SARAIVA, R. A. Sequência de Fluxo de Gás Fresco para Início da Anestesia com Baixo Fluxo: Aplicação Clínica do Estudo Teórico de Mapleson. Revista Brasileira de Anestesiologia. Vol. 52, Nº 2, Março – Abril, 2002
- FONSECA, N. M. LEÃO, D. G. FÉLIX, D. G. FONSECA, G. G. MANDIM, B. L. S. RUZZI, R. A. MARTINS, N. A. COSTA, P. R. R. M. Anestesia com fluxo basal de gases (Quantitativa). Revista Med Minas Gerais. Vol. 21(4 Supl 4): S15-S26. 2011.
- BRATTWALL, M; MD, PhD. STOMBERG, M. W; PhD. HESSELVIK, F; MD, PhD. JAKOBSSON, J; MD, PhD. Brief review: Theory and practice of minimal fresh gas flow anesthesia. Can J Anesth/J Can Anesth. Vol. 59:785–797. 2012.
- BILGI, M; GOKSU, S; MIZRAK, A; et al. Comparison of the effects of low-flow and high-flow inhalational anaesthesia with nitrous oxide and desflurane on mucociliary activity and pulmonary function tests. Eur J Anaesthesiol. Vol. 28: 279-83. 2011.
- BENGTSON, J. P. SONANDER, H. STENQVIST, O. Comparison of costs diferente anaesthethic techniques. Acta Anaesth. Vol. 32:33-2. Scand, 1988.
- COTTER, S. M. PETROS, A. J. et al. Low flow anaesthesia. Practice, cost implications and acceptability. Anaesthesia. Vol. 46: 1009-1012, 1991.
- FEISS, P. DEMONTOUX, M. H. COLIN, D. Anaesthetic gas and vapor saving with minimal flow anaesthesia. Acta Anaesthesiol. Belg. Vol. 41: 249-251, 1990.
- Ortega RA, Mai C. History of anesthesia. In: Vacanti CA, Sikka PK, Urman RD, et al., eds. Essential Clinical Anesthesia. Cambridge: Cambridge University Press; 2011:1–6
